Osteomalacia hipofosfatémica secundaria a sarcoma de muslo. Caso clínico
Rafael Ríos S.1,2, Cristina Goens G.2, Josefina Jofré M.3, Virginia Martínez C.4 y Néstor Soto I.1
Hypophosphatemic osteomalacia secondary to a sarcoma. Report of one case
1Unidad de Endocrinología y Diabetes Hospital Clínico San
Borja-Arriarán.
2Departamento de Medicina Campus Centro Universidad de
Chile.
3Centro PET- Medicina Nuclear Hospital Militar.
4Anatomía Patológica Facultad de Medicina Universidad de
Chile y Clínica Santa María.
Correspondencia:
Néstor Soto I.
Unidad de Endocrinología y Diabetes
Hospital San Borja-Arriarán.
Amazonas 619
Fono: 5748784.
E-mail: nsoto@manquehue.net
Recibido: 16 de Septiembre de 2009
Aceptado: 14 de Diciembre de 2009
Tumor induced osteomalacia is uncommon and is characterized by an isolated
and not PTH dependent reduction in tubular phosphate reabsorption. This alteration
is produced by phosphaturic factors, such as fibroblast growth factor-23
(FGF-23) that are secreted by tumors. We report a 41 years old female presenting
with joint pain and progressive loss of muscle strength in the lower limbs.
Initial laboratory assessment showed hypophosphatemia, elevated alkaline phosphatases,
normal intact parathormone levels, low levels of 25 hydroxy vitamin
D and an elevated 24 h phosphaturia. Bone mineral density showed spine and
femoral neck osteopenia. A positron emission tomography (PET) revealed a right
thigh tumor with lung metastases. Its biopsy disclosed a fibrosarcoma. FGF-23
levels, measured by ELISA were markedly elevated. The patient was discharged
with palliative measures.
Key words: Tumor-induced osteomalacia, fibroblast growth factor 23, neoplasms.
La Osteomalacia Inducida por Tumor (TIO) es un raro trastorno metabólico óseo, del cual existen aproximadamente 120 casos comunicados en la literatura1. Este cuadro ocurre como consecuencia de la pérdida renal de fosfato inducida, entre varios otros factores, por el Factor de Crecimiento de Fibroblastos-23 (FGF-23); además se caracteriza por una síntesis anormal de calcitriol. FGF-23 puede ser producido en exceso de forma paraneoplásica por distintos tipos de tumores, que pueden estar inicialmente ocultos y su medición, no disponible rutinariamente en nuestro país, constituye una clave diagnóstica. En el presente caso discutimos su utilidad, así como el valor de la tomografía por emisión de positrones (PET) en la localización de estos tumores.
Caso clínico
Mujer de 41 años, sin antecedentes mórbidos de importancia, consultó en 2005 por poliartrartralgias asociadas a pérdida progresiva de fuerza en las extremidades inferiores, de predominio proximal, con limitación de la marcha. Al examen físico se objetivó paresia proximal de la cintura pelviana y extremidades inferiores con atrofia de cuadriceps; una biopsia de muslo derecho mostró variación leve a moderada en el tamaño de las fibras musculares, algunas muy adelgazadas con atrofia perifascicular, sin actividad inflamatoria ni elementos sugerentes de neoplasia. Los exámenes serológicos: perfil bioquímico, hormonas tiroideas, factor reumatoide, anticuerpos antinucleares, anticardiolipinas, C3 y C4, creatinfosfoquinasa (CK) total fueron normales. La endoscopía digestiva alta, colonoscopía, ecografía pelviana, mamografía y radiografías de pelvis, tórax y columna dorso-lumbar no mostraron anormalidad. Destacaba un hematocrito de 26% con VCM 67,6 fL y hemoglobina 8,4 g/dL, con normalidad del resto de las series del hemograma. Con el diagnóstico presuntivo de artritis seronegativa se inició tratamiento con prednisona y metotrexato, sin obtener respuesta, por lo que fue derivada a nuestro centro.
Al ingreso destacaba hipofosfatemia 0,7 mg/dL (VN: 2,7- 4,1 mg/dL) y elevación de fosfatasas alcalinas 327 UI/L (VN: 44-147 UI/L). Presentó normales la función renal y hepática, CK total y una electromiografía, pedida para descartar polineuropatía. Con el diagnóstico presuntivo de TIO se realizó: PTH intacta 47,8 pg/mL (VN: 15-65 pg/mL); 25- OH-D: 11,5 ng/mL (VN: 20-60 ng/mL); fosfaturia: 1,4 g/24h (VN: 0,34-1 g/24 h); glucosuria negativa; las radiografías de escápulas y huesos largos mostraron osteopenia difusa. Una densitometría ósea (LUNAR) informó osteopenia, con Z score -1,9 en L2-L4, y -1,8 y -1,7 en cuello femoral izquierdo y derecho, respectivamente. El cintigrama óseo evidenció aumento focal del trazador en diversas zonas, sugerente de enfermedad ósea metabólica. En el estudio de la anemia, sólo destacó una gastritis erosiva, con negatividad del test para hemorragia oculta en deposiciones, anticuerpos antiendomisio negativos y test de Sudán positivo en una de dos muestras. La ecografía y la tomografía axial computada abdominal fueron normales.
Se realizó una PET que evidenció un tumor en el muslo derecho e imágenes pulmonares compatibles con metástasis (Figura 1). La biopsia del muslo mostró un tumor que infiltraba la musculatura estriada y el tejido óseo, correspondiente a sarcoma fusocelular G2 concordante con fibrosarcoma (Figura 2). Se tomó muestra venosa periférica en antebrazo derecho para medición de FGF-23 por método ELISA, que resultó muy elevado, > 5.000 unidades de referencia (RU)/mL, (VN < 150 RU/mL). Se procedió a amputar la extremidad inferior derecha y se planificó la resección de la metástasis; sin embargo, al momento de la intervención se encontraron múltiples metástasis pulmonares inabordables, por lo cual la paciente fue dada de alta con tratamiento paliativo, recibiendo bifosfato de sodio, calcio y 1,25 dihidroxi-D3. Pasado un año desde el alta se encontraba en condiciones similares a las de su egreso.
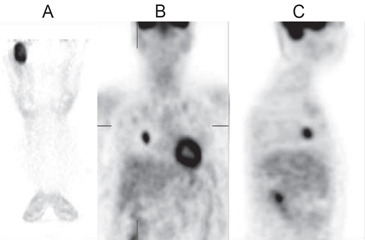 Figura 1. PET-FDG: Se aprecia marcado aumento
de la captación del trazador en la lesión del muslo
proximal derecho (corte coronal, A) y en metástasis
pulmonar derecha (corte coronal, B, en el que se
ve también actividad fisiológica de corazón, y corte
sagital, C).
Figura 1. PET-FDG: Se aprecia marcado aumento
de la captación del trazador en la lesión del muslo
proximal derecho (corte coronal, A) y en metástasis
pulmonar derecha (corte coronal, B, en el que se
ve también actividad fisiológica de corazón, y corte
sagital, C).
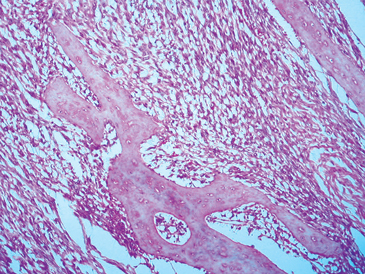 Figura 2. Biopsia de muslo que muestra proliferación de células
fusadas, con compromiso de trabéculas óseas (hematoxilina-eosina
250x).
Figura 2. Biopsia de muslo que muestra proliferación de células
fusadas, con compromiso de trabéculas óseas (hematoxilina-eosina
250x). Discusión
La TIO es un trastorno muy infrecuente caracterizado por hipofosfatemia, hiperfosfaturia, normalidad de calcemia, PTH y 25-OHD, con niveles inapropiadamente normales o disminuidos de 1,25 OHD3, dado que estos debieran elevarse en respuesta a la hipofosfatemia. Aunque no tuvimos la posibilidad de medir calcitriol, creemos que éste se habría encontrado bajo. También se pueden encontrar fosfatasas alcalinas elevadas y frecuentemente fracturas.
Las características clínicas y bioquímicas de este cuadro son similares a las de la Hipofosfatemia Ligada al Cromosoma X (HLX) y al Raquitismo Hipofosfatémico Autosómico Dominante (RHAD)1.
El hecho fisiopatológico central de esta condición reside en la pérdida renal de fosfato y metabolismo anormal de la vitamina D. Extractos tumorales inhiben tanto el transporte de fosfatos en las células epiteliales renales como la hidroxilación de 25OHD1. Inicialmente, para referirse a estas substancias se utilizó el término genérico de "fosfatoninas", las cuales se han ido identificando. El elemento más frecuente inductor de esta fosfaturia es el FGF-23, que en ratones inhibe en el túbulo renal proximal a los co-transportadores fosfato-sodio tipo IIa y IIc, produciendo menor reabsorción de fosfato e inhibición de la 25 OHD 1a-hidroxilasa, traduciéndose en menor síntesis de 1,25OHD2. Otros factores con efecto sobre el transporte renal de fosfatos son: "secreted frizzled related protein sFRP4", "matrix extracellular phosphoglycoprotein MEPE" (asociado a sarcomas)3 y FGF-74.
El efecto fosfatúrico de FGF-23 depende de su unión con los receptores de FGF (FGFRs); se ha observado que la potencia de su acción aumenta cuando a los FGFRs se une la proteína Klotho, que se expresa predominantemente en el riñón y actuaría junto a FGF-23 a través de una vía común de transducción de señales5.
La medición de FGF 23 en el tejido tumoral y posteriormente en el plasma se inició el año 20026,7 y ha sido útil tanto en la confirmación diagnóstica como en el pronóstico, porque si el tumor no es removido completamente sus niveles persistirán elevados después del tratamiento quirúrgico8. No en todos los casos de TIO se observa elevación de FGF-239 y los niveles elevados de FGF-23 no siempre permiten distinguir los pacientes con tumor de aquellos con HLX, porque en estos últimos la elevación se debería al defecto de la enzima que lo degrada. La dificultad en el diagnóstico diferencial se da en casos leves de HLX que se presentan tardíamente, aunque en la mayoría de los casos la historia y el contexto clínico permiten establecer un diagnóstico claro. En el RHAD, aunque también se puede encontrar elevación de FGF-23 debido a la presencia de una mutación que lo hace resistente a la degradación, existe un cuadro clínico característico1. En pacientes con insuficiencia renal se puede encontrar niveles altos de FGF-239, pero con concentraciones normales o aumentadas de fosfato sérico. En las ocasiones en que se torna difícil establecer si un tumor es el culpable de la osteomalacia, se ha utilizado el muestreo venoso selectivo con medición de FGF-23, comparándolo con niveles sistémicos10.
Los tumores asociados a osteomalacia son de origen mesenquimático, polimorfos, complejos y de crecimiento lento. Los más frecuentes son los del tipo PMTMCT (Tumores fosfatúricos mesenquimáticos de tejido conectivo mixto), que incluye a los hemangiopericitomas. Los PMTMCT constituyen más del 80% de los tumores asociados a TIO2. La histología suele ser benigna, aunque también se han comunicado casos de sarcoma11. Los tumores suelen ser difíciles de localizar, pequeños o estar en ubicaciones inhabituales, más comúnmente craneofaciales y en extremidades1.
El PET con flúor 18-fluordeoxiglucosa (F18-FDG) funciona sobre el principio de aumento de la captación de glucosa marcada con radioactividad por parte de lesiones con alta actividad metabólica, con aumento de la utilización de glucosa o del flujo sanguíneo. En 2005, Dupond et al. comunicaron el primer caso de TIO localizado por PET/ CT, luego del cual se han documentado otros casos en que esta técnica ha sido útil para localizar lesiones cuando otros métodos de imágenes han fallado12. En nuestro caso, si bien la lesión del muslo derecho era palpable, la biopsia previa no fue concluyente. El PET permitió confirmar la causa y detectar una metástasis pulmonar. Otros exámenes útiles para localizar el tumor son la resonancia nuclear magnética y el cintigrama con 111In-octreotide, el cual es útil para detectar tumores que expresan receptores de somatostatina1.
El tratamiento de elección, si es posible, es la resección completa del tumor. Después de ello, la fosfatemia, 1,25OHD3 y el índice de eliminación renal de fosfato retornarán a lo normal en horas a días. Las fosfatasas alcalinas también debieran normalizarse, pero los cambios esqueléticos pueden requerir meses para corregirse9.
En Chile, ha habido pocos casos comunicados. En nuestro centro, Fuentealba y cols, documentaron el caso de una mujer de 63 años con un hemangiopericitoma nasal, el cual nunca pudo ser completamente resecado13 y Sapunar y cols, trataron exitosamente a un varón portador de un hemangioendotelioma compuesto ubicado en el ortejo mayor del pie14. En ambos casos no estaba disponible aún la medición de FGF-23.
Si bien los tumores causantes de esta patología son de crecimiento lento y frecuentemente benignos, es fundamental el diagnóstico oportuno para ofrecer un tratamiento curativo. El tiempo promedio desde el inicio de los síntomas al diagnóstico excede 2,5 años y una vez diagnosticado, la localización del tumor puede tardar hasta 5 años1. La presencia de hipofosfatemia severa y persistente con fosfaturia aislada, acompañada de calcemia, 25-OHD y PTH normales y fosfatasas alcalinas elevadas, debe hacer sospechar una TIO y luego proceder a la búsqueda del tumor. De ser posible, la medición de FGF-23 constituye una herramienta útil para el diagnóstico y seguimiento de la enfermedad.
Agradecimiento
Al Dr. Harald Jüppner, del Massachusetts General Hospital and Harvard Medical School por realizar gentilmente la medición de FGF-23.
Referencias
- Jan de Beur SM. 2005. Tumor-induced Osteomalacia. JAMA 294: 1260-1267.
- Hannan FM, Athanasou NA, Teh J, Gibbons CLM, Shine B, Thakker RV. 2008. Oncogenic hypophosphataemic osteomalacia: biomarker roles of fibroblast growth factor 12, 1,25-dihydroxyvitamin D3 and lymphatic vessel endotelial hyaluronan receptor 1. Eur J Endocrinol 158: 265-271.
- Berndt TJ, Schiavi S, and Kumar R. 2005. "Phosphatonins" and the regulation of phosphorus homeostasis. Am J Physiol Renal Physiol 289: F1170-F1182.
- Carpenter TO, Ellis BK, Insogna K L, Philbrick WM, Sterpka J, Shimkets R. 2005. Fibroblast Growth Factor 7: An Inhibitor of Phosphate Transport Derived from Oncogenic Osteomalacia-Causing Tumors. J Clin Endocrinol Metab 90: 1012-1020.
- Kurosu H, Ogawa Y, Miyoshi M, Yamamoto M, Nandi A, Rosenblatt KP, et al. 2006. Regulation of Fibroblast Growth Factor-23 signaling by Klotho. J Biol Chem 28: 6120-6123.
- Kamazaki Y, Okazaki R, Shibata M, Hasegawa Y, Satoh K, Tajima T, et al. 2002. Increased circulatory level of biologically active full-length FGF-23 in patients with hypophosphatemic rickets/ osteomalacia. J Clin Endocrinol Metab 87: 4957-4960.
- Nelson AE, Bligh RC, Mirams M, Gill A, Au A, Clarkson A, Jüppner H, et al. 2003 Fibroblast Growth Factor 23: A New Clinical Marker for Oncogenic Osteomalacia. J Clin Endocrinol Metab 88: 4088-4094.
- Zimering MB, Caldarella FA, White KE, Econs MJ. 2005. Persistent tumor-induced osteomalacia confirmed by elevated postoperative levels of serum Fibroblast Growth Factor-23 and 5-year follow-up of bone density changes. Endocr Pract 11: 108-114.
- Jonsson KB, Zahradnik R, Larsson T, White K, Sugimoto T, Imanishi Y, et al. 2003. Fibroblast Growth Factor 23 in oncogenic osteomalacia and X-linked hypophosphatemia. N Engl J Med 348 (17): 1656-1663.
- Takeuchi Y, Suzuki H, Ogura S, Imai R, Yamazaki Y, Yamashita T, et al. 2004.Venous sampling for Fibroblast Growth Factor-23 confirms preoperative diagnosis of Tumor-induced Osteomalacia. J Clin Endocrinol Metab 89: 3979-3982.
- Lamont E, Kavaghan MK, Brockstein BE. 1999. Osteogenic Osteomacia as a harbinger of recurrent osteosarcoma. Sarcoma 3: 95-99.
- Dupond JL, Mahammedi H, Prié D, Collin F, Gil H, Blagosklonov O, et al. 2005. Oncogenic osteomalacia: diagnostic importance of fibroblast growth factor 23 and F-18 fluorodeoxyglucose PET/CT scan for the diagnosis and follow-up in one case. Bone 36: 375-378.
- Fuentealba C, Pinto D, Ballesteros F, Pacheco D, Boettiger O, Soto N, et al. 2003. Oncogenic Hypophosphatemic Osteomacia Associated with a Nasal Hemangiopericytoma. Journal Clin Rheumatol 9: 373-379.
- Sapunar J, Roa JC, Moscoso S. 2003. Hipofosfatemia revertida al extirpar hemangioendotelioma compuesto del dedo mayor del pie. Rev Méd Chile 131: 909-914.