Influencia de la Diabetes Mellitus tipo 2 en el deterioro cognitivo en un grupo de adultos mayores
Victoria Novik A.1,2, Soledad García F. 2,a, Francisca Heller F.2,a y Javiera Mercado A.2,a
Cognitive decline in diabetic and non-diabetic older subjects
1Departamento de Endocrinología, Servicio de Medicina Interna, Hospital Dr. Gustavo Fricke, Viña del Mar.
2Cátedra de Metodología de la Investigación. Escuela de Medicina, Universidad de Valparaíso.
aInterna de Medicina.
Conflicto de intereses: no los hay.
Correspondencia:
Dra. Victoria Novik A.
Asturias 1750 casa 6,
Viña del Mar Alto.
E-mail: victorianovik@gmail.com
Recibido: 22 de Octubre de 2010
Aceptado: 23 de Noviembre de 2010
Background: Type 2 Diabetes mellitus may be associated with cognitive decline (CD) in older subjects. Aim: To determine if CD is more common among diabetic subjects that their non-diabetic counterparts. Material and Methods: Using a case-control design, 17 diabetic patients with a median age of 73 years (nine females) and 21 non diabetic subjects with a median age of 72 years (17 females), with a similar educational background, were studied. Cognitive status was assessed using the Mini mental State Examination (MMSE), using a cutoff point of 23, and the Frontal Assessment Battery (FAB), that evaluated conceptualization, mental flexibility, motor initiative, sensibility to interference, inhibitory control, and environmental autonomy. The presence of any mental or organic cerebral disease, sensorial impairment or illiteracy were considered exclusion criteria. Results: Fifty nine percent of diabetic subjects and 24% of their non-diabetic counterparts, had a MMSE below the cutoff point (p = 0.03). An abnormal FAB was found in 29 and 14% of diabetic and non-diabetic subjects, respectively (p = NS). Both tests were abnormal in 29 and 5% of diabetic and non-diabetic subjects, respectively (p = 0.05). Conclusions: In this group of subjects, CD was more common among diabetics than their non-diabetic counterparts.
Key words: Type 2 diabetes, Cognitive decline, Minimental State Examination (MMSE), Frontal Assessment Battery (FAB).
La Diabetes Mellitus tipo 2 (DM2) es una enfermedad crónica, degenerativa y de etiología multifactorial. Se estima una prevalencia de hasta un 7,2% de la población total1,4,5, encontrándose en Chile entre 4,2 y 7,5%2-4.
La relevancia clínica de la DM2 está constituida por sus complicaciones. Dentro de las complicaciones crónicas se incluye el deterioro cognitivo (DC) progresivo, que puede incluso llegar a demencia, el que sería producto del envejecimiento, de cambios neurovegetativos, y de un cierto grado de atrofia cortical y subcortical6-14. Se ha adjudicado a la hiperinsulinemia y a las anormalidades en la sensibilidad a la insulina observadas en estos pacientes un cierto rol etiopatogénico respecto del DC, aunque se requiere de más estudios para confirmarlo8. Además, se ha sugerido una asociación entre el metabolismo de la insulina y la patogenia de la Enfermedad de Alzheimer8,15.
El envejecimiento suele asociarse a un declive cognitivo, más frecuente a partir de los 65 años, que depende tanto de elementos patológicos como de factores ambientales, y que está sujeto a una gran variabilidad interindividual16. Entre los primeros destaca la hipertensión arterial, el tabaquismo, y otras como la DM2, que tiene una prevalencia de 10 a 20% en mayores de 65 años de edad1,17,18. La DM2 es un trastorno complejo, que en cuanto al compromiso cerebral, involucra a muchos factores relacionados con la enfermedad, con su tratamiento, y con las complicaciones crónicas y la comorbilidad7.
Arvanitakis y cols, encontraron en autopsias realizadas a ancianos de edad promedio de 86 años, una relación positiva entre DM e infartos cerebrales, pero no entre DM y enfermedad de Alzheimer19. En un estudio en diabéticos adultos mayores, la microalbuminuria fue un factor que se asoció a la declinación cognitiva, mientras que las drogas que inhiben el sistema renina-angiotensina-aldosterona aparecieron como protectoras20.
Con los antecedentes expuestos, el objetivo del presente estudio fue evaluar la frecuencia de DC en pacientes de 65 años o más, y determinar una eventual relación con la presencia de DM2, mediante la aplicación del Minimental State Examination21-23 y el Frontal Assessment Battery24,25.
Pacientes y Método
Se realizó un estudio de caso-control, donde la población en estudio estuvo compuesta por pacientes de 65 años de edad o más que asistieron a control al consultorio adosado de especialidades de Medicina Interna del Hospital Dr. Gustavo Fricke (HGF) de Viña del Mar, entre el 30 de junio y el 30 de noviembre del año 2007. Se excluyeron los pacientes analfabetos, con antecedentes de enfermedad cerebrovascular, enfermedad mental, de demencia o con alteraciones sensoriales como sordera o ceguera. Los instrumentos se aplicaron a pacientes seleccionados al azar. Todos los individuos manifestaron su consentimiento informado. Los casos correspondieron a los pacientes con DM2 y los controles a los individuos sin esta condición.
Para la recolección de datos se utilizaron los siguientes instrumentos:
1. Cuestionario de recolección de datos demográficos: Se consignó edad, sexo, escolaridad, estado civil, hábitos (tabaco, alcohol, drogas y actividad física), consumo de medicamentos y antecedentes mórbidos. En caso de padecer DM2, se consignó el tiempo de evolución de la enfermedad y la fecha del último control. No se dispuso de información respecto del grado de control (glicemia o hemoglobina glicosilada).
2. Mini Mental State Examination (MMSE): Este test, de 10 a 15 minutos de duración, explora y evalúa el nivel de cognición mediante 6 secciones: orientación temporo-espacial, capacidad de atención y concentración, memoria, capacidad de abstracción, capacidad de lenguaje y percepción visuo-espacial; cada respuesta correcta tenía el valor de un punto, para alcanzar un puntaje máximo de 30. Se consideró DC cuando el puntaje total obtenido era menor a 2321-23.
3. Frontal Assesment Battery (FAB): Este test, de 10 minutos de duración, se divide en seis secciones que exploran: conceptualización, flexibilidad mental, programación motora, sensibilidad a la interferencia, control inhibitorio, y autonomía del ambiente. Se consideró DC cuando el puntaje total obtenido era menor a 924-25. Este instrumento detecta específicamente la disfunción del lóbulo frontal (se utiliza especialmente para estudio de demencia fronto temporal), lo cual, aunque no característico, podría estar presente en pacientes diabéticos.
La información se almacenó en una base de datos MS Excel, y se analizó en Stata v.8. Las variables cualitativas se describen como frecuencias absolutas o relativas, y las cuantitativas mediante medianas y rango intercuartil. Se determinó la significancia estadística a través de la prueba exacta de Fisher. Se estimó el riesgo mediante "Odds Ratio" (OR). Para todos los análisis se consideró significativo un p igual o menor a 0,05.
Resultados
En el período evaluado se entrevistó a 38 individuos, los cuales fueron divididos en dos grupos de estudio: con DM2 y sin DM2. No hubo diferencias significativas al analizar edad ni frecuencia por género (Tabla 1). Los pacientes de DM2, primaria. No todos disponían de Hemoglobina Glicosilada (Hb A1c) en el último control; sin embargo, el promedio de éste examen en los 12 pacientes en que se dispuso era de 8,2% y ninguno del total usaba o tenía indicado tratamiento con insulina.
Tabla 1. Características basales de los grupos del estudio
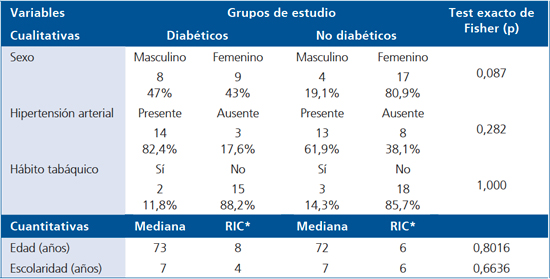
*RIC= Rango Intercuartil.
En el grupo de pacientes con DM2, hubo mayor número de individuos con DC que en el grupo sin DM2, detectado tanto por MMSE como por FAB, existiendo una asociación significativa entre la presencia de DM2 y la ocurrencia de DC según MMSE (p = 0,033), pero no así según FAB (p = 0,23). Sin embargo, no se observa una diferencia significativa (p = 0,052) al analizar esta diferencia considerando DC de acuerdo a los dos instrumentos en conjunto (Tabla 2).
Tabla 2. Frecuencia de DC* en pacientes con o sin Diabetes Mellitus Tipo 2
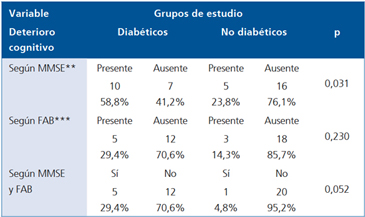
*DC= Deterioro Cognitivo. **MMSE= Minimental State Examination. ***FAB= Frontal Assessment Battery.
Tabla 3. "Odd Ratios" para ocurrencia de DC* en grupo con DM2**

*DC= Deterioro Cognitivo. **DM2= Diabetes Mellitus Tipo 2. ***MMSE= Minimental State Examination. ****FAB= Frontal Assessment Battery.
Tabla 4. Factores de riesgo en pacientes con y sin deterioro cognitivo
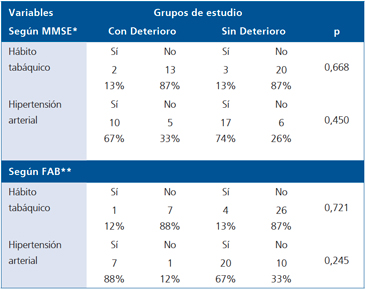
*MMSE= Minimental State Examination. **FAB = Frontal Assessment Battery.
Al medir el riesgo de presentar deterioro cognitivo con MMSE, se apreció que los pacientes del grupo con DM2 tenían un OR de 4,5 respecto a los pacientes del grupo sin DM2, p = 0,033. Sin embargo, al estimarlo según FAB, no se apreció mayor riesgo (p = 0,264) (Tabla 3). No se demostró asociación entre hábito tabáquico o hipertensión arterial y la presencia de DC, medido según MMSE y FAB (Tabla 4).
Discusión
Ambos grupos de pacientes, con y sin DM2, resultaron comparables respecto a sexo, edad, escolaridad, presencia de hipertensión arterial y hábito tabáquico. Si bien el MMSE tiene importantes limitaciones según el nivel de escolaridad, especialmente en sujetos con menos de 6 años de educación, esta variable fue similar en ambos grupos. En la literatura se ha señalado que quienes padecen DM2 tienen un mayor riesgo de presentar DC6-14,26. Los resultados encontrados en este estudio muestran que el MMSE detectó una asociación significativa entre la presencia de DM2 y DC, pero no así al analizarlo con FAB. Una explicación posible para esta diferencia podría radicar en que ambos tests evalúan distintas áreas cognitivas, las cuales en el adulto mayor no declinan simultáneamente a lo largo del tiempo. En ese sentido, la memoria es una de las primeras áreas cognitivas que se ve afectada en el envejecimiento y corresponde a una de las seis secciones de la cognición que explora y evalúa el MMSE, pero no el FAB21-25. En todo caso, el MMSE es el test más usado en la literatura para medir DC en DM9,28,29. Por otro lado, el FAB ha demostrado ser un instrumento sensible al déficit de funciones ejecutivas, por lo que es recomendable su inclusión en estudios de demencias y como instrumento complementario en la evaluación del deterioro cognitivo en otras patologías24-25. Hubiera sido interesante un análisis de las subescalas del MMSE y FAB para determinar si alguno de los dominios fue más afectado en el grupo con DM2; sin embargo, el número reducido de pacientes no lo permitió.
Otros estudios señalan que pacientes con hipertensión arterial y con hábito tabáquico tienen mayor riesgo de presentar DC que los normotensos y no fumadores17, situación que no se observó en este estudio. Se ha publicado que un mejor control de la hiperglicemia postprandial podría prevenir el DC en pacientes DM2 mayores28, lo que apoyaría el rol de la DM2 en la génesis del deterioro. Este dato no pudo ser obtenido al no disponer de la ficha clínica.
Las limitaciones de nuestro estudio fueron el haber aplicado las pruebas en una sala de espera de un consultorio de especialidades, y el limitado tamaño de la muestra. Sin embargo, consideramos que lo primero no constituyó un conflicto para los pacientes encuestados, quienes no manifestaron molestia ni distracción alguna mientras se les aplicaban los tests. Respecto del tamaño muestral, aunque pequeño, tiene la importancia de mostrar una realidad local para una complicación de la DM2 no tan considerada, aunque no permite extrapolar los resultados a la población general. Este tamaño muestral pequeño, probablemente contribuyó a que la asociación entre la presencia de DC según ambos tests en conjunto no fuera significativa. Hay que considerar, además, que el MMSE puede arrojar un mayor número de falsos positivos27. La fortaleza de este estudio fue el evaluar DC mediante la aplicación en el medio local de escalas validadas y reconocidas internacionalmente.
Los mecanismos de la asociación entre DC y DM2 no están clarificados, pero son motivo de intensa investigación en varios centros mundiales; tal vez en el futuro la DM2 sea considerada como un factor de riesgo de demencia modificable7.
En conclusión, al evaluar DC en pacientes de 65 años o más con DM2, mediante la aplicación del MMSE, se apreció una asociación significativa entre ambos parámetros, situación que no se replicó al evaluarlo con FAB. Son necesarios estudios de mayor tamaño para corroborar esta asociación y correlacionar el DC con los niveles de control glicémico y con la presencia de complicaciones crónicas, así como descartar otras causas de DC, lo que no estuvo dentro de los objetivos de este estudio. A pesar de lo anterior, nos pareció interesante comunicar estos resultados, para estimular la inquietud por este tema a nivel nacional.
Agradecimientos
A los Drs. Claudio Fuentes, por su colaboración en la realización del estudio, Erick Rosas por la asesoría neurológica y a M. Soledad Báez y Felipe Cardemil, por la revisión del manuscrito.
Referencias
- 1. Wild SW, Roglic G, Green A, Sicree R, King H. 2004. Global prevalence of diabetes. Diabetes Care 27: 1047-1053.
- Ministerio de Salud, Chile, Encuesta Nacional de Salud año 2003. http://epi.minsal.cl/epi/html/invest/ENS/folletoENS.pdf (Revisión actualizada el 25 de Septiembre del año 2008).
- Baechler R, Mujica V, Aqueveque X, Ramos L, Soto A. 2002. Prevalencia de diabetes mellitus en la VII Región de Chile. Rev Med Chile 130: 1257-1264.
- Solís CL, Aguirre ML, Godorecci S, Mois P, Rojas H, Jiménez R.
2008. Prevalencia de Diabetes mellitus en Chile. Revista de la Asociación Latinoamericana de Diabetes XVI: 93-97.
- Mokdad AH, Bowman BA, Ford ES, Vinicor F, Marks JS,
Koplan JP. 2001. The continuing epidemics of obesity and diabetes in the United States. JAMA 286: 1195-1200.
- Zavala M, Vázquez O, Whetsell M. 2006. Bienestar espiritual y ansiedad en pacientes diabéticos. Revista Aquichan 6: 8-21.
- Biessels GJ, Deary IJ, Ryan CM. 2008. Cognition and diabetes: a lifespan perspective. Lancet Neurol 7: 184-190.
- Rönnemaa E, Zethelius B, Sundelöf J, Sundström J, Degerman-Gunnarsson M, Berne C, et al. 2008. Impaired insulin secretion increases the risk of Alzheimer disease. Neurology 71: 1065-1071.
- World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications. Report of a WHO consultation. Part 1: Diagnosis and classification of diabetes mellitus. Geneva: WHO, 1999.
- Strachan MWJ, Deary IJ, Ewing FME, Friere BM. 1997. Is type II diabetes associated with an increased risk of cognitive dysfunction? Diabetes Care 20: 438-445.
- Coker LH, Shumaker SA. 2003. Type 2 diabetes mellitus and cognition: an understudied issue in women's health. J Psychosom Res 54: 129-139.
- den Heijer T, Vermeer SE, van Dijk EJ, Prins ND, Koudstaal PJ, Hofman A, et al. 2003. Type 2 diabetes and atrophy of medial temporal lobe structures on brain MRI. Diabetologia 46: 1604-1610.
- Schmidt R, Launer LJ, Nilsson LG, Pajak A, Sans S, Berger K,
et al. 2004. Magnetic resonance imaging of the brain in diabetes: the Cardiovascular Determinants of Dementia (CASCADE) Study. Diabetes 53: 687-692.
- Araki Y, Nomura M, Tanaka H, Yamamoto H, Yamamoto T, Tsukaguchi I. 1994. MRI of the brain in diabetes mellitus. Neuroradiology 36: 101-03.
- Craft S, Watson GS. 2004. Insulin and neurodegenerative disease: shared and specific mechanisms. Lancet Neurol 3: 169-178.
- Calero MD, Navarro-González E. 2005. Eficacia de un programa de entrenamiento en memoria en el mantenimiento de ancianos con y sin deterioro cognitivo. Clínica y salud 17: 187-202.
- Ott A, Andersen K, Dewey E, Letenneur L, Brayne C, Copeland J, et al. 2004. Effect of smoking on global cognitive function in non demented elderly. Neurology 62: 920-924.
- Mainous AG, Baker R, Koopman RJ, Saxena S, Díaz VA, Everett CJ, et al. 2007. Impact of the population at risk of diabetes on projections of diabetes burden in the United States: an epidemic on the way. Diabetologia 50: 934-940.
- Arvanitakis Z, Schneider JA, Wilson RS, Arnold SE, Wang Z, Bennett DA. 2006. Diabetes is related to cerebral infarction but not to AD pathology in older persons. Neurology 67: 1960-1965.
- Bruce D, Davis WA, Casey G, Starkstein S, Clarnette R, Almeida O, et al. 2008. Predictors of Cognitive Decline in Older Individuals With Diabetes. Diabetes Care 31: 2103-2107.
- Dubois B, Slachevsky A, Litvan I, Pillon B. 2000. The FAB: A frontal assessment battery at bedside. Neurology 55: 1621-1626.
- Yesavage JA. 1975. Mini-Mental State: A practical method for grading the cognitive state of patients for the clinicians. J Psych Res 12: 189-198.
- Folstein MF, Folstein SE, McHugh PR. 1975. "Mini-mental state''. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 12: 3189-98.
- Lipton A, Ohman KA, Womack KB, Hynan LS, Ninman ET,
Lacritz BS. 2005. Subscores of the FAB differentiate frontotemporal lobar degeneration from AD. Neurology 65:
726-731.
- Slachevsky A, Villalpando JM, Sarazin M, Hahn-Barma V,
Pillon B, Dubois B. 2004. Frontal Assessment Battery and Differential Diagnosis of Frontotemporal Dementia and Alzheimer Disease. Arch Neurol 61: 1104-1110.
- Van den Berg E, De Craen AJM, Biessels GJ. 2006. The impact of diabetes mellitus on cognitive decline in the oldest of the old: a prospective population-based study. Diabetología 49: 2015-2023.
- Quiroga, Albala C, Klaasen G. 2004. Validación de un test de tamizaje para el diagnóstico de demencia asociada a edad, en Chile. Rev Med Chile 132: 467-478.
- Abbatecola AM, Rizzo MR, Barbieri M, Grella R, Arciello A, Laieta MT, et al. 2006. Postprandial plasma glucose excursions and cognitive functioning in aged type 2 diabetics. Neurology 67: 235-240.
- Biessels GJ, Staekenborg S, Brunner E, Brayne C, Scheltens P. 2006. Risk of dementia in diabetes mellitus: a systematic review. Lancet Neurol 5: 64-74.
- Williamson JD, Miller ME, Bryan N, Lazar RM, Coker LH, Johnson J, et al. 2007. For the ACCORD Study Group. The Action to Control Cardiovascular Risk in Diabetes Memory in Diabetes Study (ACCORD-MIND): Rationale, Design, and Methods. Am J Cardiol 99 [suppl]: 112i–122i.