Aldosterona e IL-17 en la génesis de la hipertensión arterial mineralocorticoídea, un estudio ex vivo
Andrea Vecchiola C.1, Cristóbal Fuentes Z.1, Natalia Muñoz-Durango2,
Alejandra Tapia-Castillo1, Luis M. González-Gómez1, René Baudrand B.1, Cristian Carvajal M.1,
Carmen Campino J.1, Alexis Kalergis P.2, Carlos F. Lagos A.1 y Carlos Fardella B.1
Aldosterone and il-17 in the genesis of mineralocorticoid arterial hypertension: an ex vivo study
1Departamento de Endocrinología. Facultad de Medicina. Pontificia Universidad Católica de Chile.
2Laboratorio de Microbiología. Departamento de Genética Molecular y Microbiología.
Correspondencia a: Dr. Carlos Fardella E-mail: cfardella@med.puc.cl Dra. Andrea Vecchiola E-mail: andreavecchiola@gmail.com Facultad de Ciencias Biológicas. Pontificia Universidad Católica de Chile. Alameda 340, Casilla 114-D, Santiago de Chile.
Recibido: 29-09-2015
Aceptado: 09-12-2015
Background: Treatment of dendritic cells (DC) with aldosterone induces the secretion of IL-6 and
TGF-β. The polarization of naïve T cells to helper 17 T lymphocytes with DCs pre-incubated with
aldosterone, has been described in vivo, generating an IL-17 hyper-secreting phenotype, a cytokine
associated with cardiac and renal fibrosis. There are mineralocorticoid receptors (MR) in immune
cells and their activation may determine the inflammatory (M1) or adaptive (M2) macrophage phenotype.
Aldosterone levels could regulate immunogenic gene expression in these cells, modulating
the liberation of specific cytokines. Aim: To assess in humans the association of aldosterone levels
and IL-17 with inflammatory markers in peripheral blood mononuclear cells (PBMC). Material and
Methods: In blood samples of 176 participants aged 18 to 67 years (61% women) with a body mass
index of 27.1 ± 4.8 kg/m2, aldosterone, plasma renin activity (ARP), cortisol, C reactive protein, and
IL-17 were measured. mRNA was isolated from PBMCs to measure the expression of MR RAC-1,
HO-1, TLR-4, CD-14, NGAL and IL-17 by real time polymerase chain reaction. Results: Aldosterone
correlated positively with ARP and the expression of CD-14 in PBMCs. Plasma levels of IL-17 were
positively associated with the expression of MR, Rac1a and NGAL. Conclusions: Aldosterone and IL-
17 levels were associated with inflammatory activation markers in PBMC, which could activate MR
and promote a subclinical inflammatory status inducing hypertension.
Key words: Aldosterone, interleukin 17 (IL-17), mineralocorticoid receptor (MR).
La hipertensión arterial (HTA) es una importante factor de riesgo de morbilidad y mortalidad en el mundo entero1,2 y es considerada como un predictor de las patologías cardiovasculares3. Una causa común de hipertensión secundaria es el aldosteronismo primario (AP)4,5, caracterizado por la producción excesiva y autónoma de aldosterona, independiente del sistema reninaangiotensina6. Aproximadamente el 15% de los pacientes hipertensos esenciales (HE) tienen niveles inapropiados de aldosterona7,8.
La aldosterona participa en el control del intercambio electrolítico del cuerpo humano, mantenimiento del balance hidrosalino y presión sanguínea a largo plazo. El principal regulador de la secreción de aldosterona es el sistema renina-angiotensina (RAS)9. La síntesis de aldosterona en la zona glomerulosa de la corteza suprarrenal es modulada por la abundancia de la enzima aldosterona sintasa la cual se induce por Angiotensina II dependiente de Renina. Esta última se sintetiza en respuesta a señales como la disminución de la filtración glomerular o disminución de la concentración de sales intratubulares10. Una vez producida la aldosterona, ésta se une al receptor de mineralocorticoides (MR) a nivel del túbulo colector distal del nefrón. El complejo formado por aldosterona-MR dimeriza y migra al núcleo en donde promueve la transcripción de genes11-14, uniéndose a elementos de respuesta hormonales (HRE) presentes en los promotores de genes específicos como el canal apical de sodio epitelial y la Na-K ATPasa basolateral15-17. En conjunto este mecanismo incrementa la reabsorción de sodio a expensas de potasio, conduciendo al aumento en la volemia y la presión sanguínea.
Recientemente, se ha demostrado que la ingesta excesiva de sal puede causar la activación del MR en ausencia de ligando18, llevando a una acción sinérgica entre la aldosterona y la ingesta excesiva de sal, aun cuando la sal disminuye los niveles circulantes de aldosterona19. Se ha propuesto que la actividad biológica del MR está regulada por Rac1, una pequeña proteína de unión a GTP, que a su vez está asociada al desarrollo de HT sal sensible y daño cardiovascular20,21. Esta GTPasa estaría modulando la expresión de marcadores de estrés oxidativo, tales como hemoxigenasa-1 (HO-1), factor nuclear-B (NF-κB), y la expresión de la lipocalina asociada a la gelatinasa de neutrófilos (NGAL), este último, también gen blanco de MR22.
Actualmente es conocido que el MR se expresa en diversos tejidos no epiteliales, tales como células del sistema inmune (dendríticas (DCs) y macrófagos), hígado, tejido adiposo, corazón, músculo liso y endotelio23. Así mismo se ha descrito la síntesis de aldosterona extraadrenal en adipocitos24-28. Más aún, se ha visto que células T reguladoras (Tregs) modulan los efectos deletéreos en modelos murinos tratados con aldosterona32. Estos estudios mostraron que la transferencia adoptiva de células T CD4+CD25+ purificadas, en ratones, previo a la infusión con aldosterona, previno efectos deletéreos como daño cardiovascular y un aumento en el estrés oxidativo cardiovascular y renal, lo que no se asoció directamente a una disminución de la presión arterial32. Es más, la transferencia de células T CD4+CD25, exacerbó la mayoría de los efectos inducidos por aldosterona, incluyendo estrés oxidativo, la expresión de proteína de adhesión a célula vascular-1 en la arteria mesentérica y en la migración de monocitos/macrófagos y células T32. Estos resultados apoyan la idea de que la activación del sistema inmune por aldosterona contribuye a empeorar el fenotipo cardíaco en modelos animales.
Estudios previos de nuestro grupo han demostrado in vitro que DCs estimuladas con aldosterona, y luego coincubadas con CD4+ inducen la polarización de linfocitos T naive a Th17, efecto revertido por antagonistas de MR33. Experimentos en ratones tratados con DOCA-Sal, también aumentaron la polarización a Th17 y aumentó la producción de IL-17A, efectos revertidos por espironolactona34. El mecanismo por el cual las aldosterona modula esta actividad en el sistema inmune no está descrito. A pesar del hecho que en la literatura describe a la IL-17A como una citoquina secretada por las células T, La mayoría de la IL‑17A liberada durante una respuesta inflamatoria es producida por las células inmunes innatas35-37. Estas evidencias sugieren la posibilidad de que aldosterona estaría modulando la actividad autoinmune en pacientes hipertensos.
La respuesta inmunitaria innata depende del reconocimiento de patrones moleculares que activan los complejos multiméricos de proteínas que constituyen el inflamasoma y producen la activación de la caspasa 1, que induce la secreción de citoquinas proinflamatorias y una forma de muerte celular. Entre los receptores de reconocimiento de patrón molecular, los TLRs son los mejores estudiados y, hasta la actualidad, el único grupo que se ha demostrado que desempeña un papel en la inflamación relacionada con la hipertensión. Los TLRs son expresados por los linfocitos T y B, células presentadoras de antígeno y las células somáticas, incluyendo las células del músculo liso vascular y endotelial.
Existe una gran variedad de moléculas de inflamación vascular y la disfunción asociadas a estos receptores de patrones moleculares capaces de activar estos TLRs, incluyendo angiotensina II38, proteína C reactiva, ácido úrico39-40 y las proteínas de estrés térmico HSP-6041 y HSP- 7042, proteína C-reactiva, ácido úrico43,44 también han sido asociados con la hipertensión esencial.
Estudios realizados en humanos han demostrado que la aldosterona tiene un impacto tanto en el sistema cardiovascular45,46 como en el sistema inmune, en los cuales se traduce en un aumento de las moléculas de estrés oxidativo o citoquinas séricas inflamatorias47. Se ha demostrado que la activación de los monocitos de pacientes con aldosteronismo primario (AP) liberan más TNF-α, IL-1β, e IL-6 comparados con los niveles presentes en los pacientes hipertensos esenciales (HE)48. Estos marcadores clásicos de inflamación por activación de TLR4, receptor cuya sensibilidad a componentes bacterianos como LPS es potenciado por CD1449, son a su vez necesarios para inducir la polarización de células Th-17A35.
En este sentido, resulta interesante estudiar la asociación
entre los niveles plasmáticos de aldosterona o la
IL-17A con marcadores plasmáticas como usPCR, leptina
y adiponectina y la expresión de marcadores proinflamatorios
en células mononucleares de sangre periférica
(PBMCs) como TLR-4, CD14, HO-1, RAC-1A, NGAL,
e IL-17.
Pacientes y Métodos
Pacientes
Se estudiaron 176 sujetos de ambos sexos mayores de 18 años de edad, (114 mujeres y 62 hombres). El protocolo de reclutamiento fue escrito de acuerdo a las guías de la declaración de Helsinki y fue aprobado por el comité de ética de la Facultad de Medicina de la Pontificia Universidad Católica de Chile (PUC). El estudio y protocolo fue explicado a todos los participantes y se obtuvo el consentimiento informado firmado de cada uno. El estudio se realizó en el Laboratorio de Endocrinología de la Pontificia Universidad Católica de Chile. con los siguientes criterios de exclusión: índice de masa corporal (IMC) mayor a 35 kg/m2, padecer enfermedades crónicas como diabetes, enfermedad hepática o renal crónica, epilepsia, cáncer; o enfermedades psiquiátricas como depresión, bipolaridad, crisis de pánico, etc. padecer alcoholismo, embarazo.
- Mediciones antropométricas: Se midió el porcentaje de grasas y peso utilizando el monitor de composición corporal y balanza OMRON modelo HBF-500INT. La talla se obtuvo utilizando el tallímetro (Harpenden stadiometer Holtain, Crymych, Pembrokeshire, UK). El IMC (kg/m2) fue calculado de los datos antropométricos considerándose con sobrepeso entre el rango 25-29,9 y obesidad ≥ 30. La presión arterial, se midió utilizando un Dinamap CARESCAPE V100, GE Healthcare, (Medical Systems Information Technologies, Milwaukee, WI)3,38, la cual fue calculada considerando tres mediciones consecutivas con intervalos de 5 min del brazo derecho, el sujeto se mantuvo sentado 15 min previos a la medición y durante el proceso. Para el patrón mineralocorticoídeo: La aldosterona fue medida en las muestras de plasma en el laboratorio central de la PUC utilizando el kit commercial, (RIA) Coat-A-Count kit (Siemens, CA). La actividad de renina plasmática (ARP) se obtuvo mediante análisis de RIA con el kit comercial (DiaSorin, Stillwater, MN)51.
- El estado inflamatorio se evaluó midiendo: La proteína C-reactiva ultra-sensible (PCRus) mediante un ensayo nefelométrico (BN ProSpec®Systems, Siemens, USA). con un CV < 5%. IL-17 mediante ELISA (IL- 17A (homodimer) de EBioscience, Ref: 88-7176-88). Se midieron los niveles de creatinina sérica. La adipoquinas séricas circulantes: La funcionalidad del adipocito se evaluó cuantificando los niveles séricos de adiponectina y leptina, analizadas por RIA (Millipore, Billerica, MA, US y Diasource, Nivelles, Belgium respectively) con un CV < 5%.
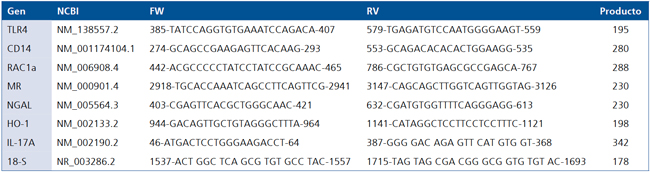
- Para determinar los niveles de ARNm en células sanguíneas periféricas mononucleares (PBMC): El ARNm de las PBMC fue aislado desde TRIZOL (Invitrogen, San Diego, California, USA) según las indicaciones del fabricante. El ARN se transcribió a cDNA y se amplificaron los genes de IL-17, Rac-1a, NGAL, TLR-4 y CD14. 18 s fue utilizado como control (Tabla 1). La amplificación de los genes fue mediante PCR en tiempo real, utilizando la enzima SYBR (MAXIMA® (K0222, Fermentas)). Los niveles de expresión fueron expresados según Livak, 200143. Se utilizaron los siguientes ciclos de amplificación: denaturación inicial: 95 °C por 5 min, seguidos por 45 ciclos a 95 °C de 15 s temperatura de alineamiento por 20 s y 15 s a 72 °C, y una curva de disociación (melting) que comienza en 72 °C y termina en 95 °C en aprox. 10 min. Las reacciones se realizaron utilizando el equipo RotorGene 6000 (Corbett Research, Sydney, Australia).
Tabla 1. Partidores usados para amplificación de genes por PCR en tiempo real
Análisis estadístico
Al aplicar pruebas de normalidad se comprobó que no existía una distribución gaussiana (p < 0,05) para las mediciones, por lo que se aplicaron pruebas no paramétricas para la comparación entre grupos. Los parámetros clínicos y bioquímicos se expresaron como promedio ± desviación estándar (± DS) o porcentaje (%). Para el cálculo de la significancia estadística se usaron los test exacto de Fisher o de Mann Whitney y se estableció como significativos un p < 0,05. En todos los casos se tuvo en cuenta un nivel de confiabilidad del 95%.
Resultados
Se estudiaron 176 pacientes cuya edad promedio fue de 42 ± 12,6 años. El grupo presentó niveles de aldosterona dentro de rango normal (promedio de 10,08 ± 9,7 ng/ dL) no detectándose pacientes con hiperaldosteronismo primario. La presión arterial también se objetivó dentro de rangos normales (PAS_X de 129,6 ± 22,9 y una PAD_X 82,68 ± 14,2 mmHg). Las mediciones de ARP fueron de 1,47 ± 1,7 (ng/mL/h) y no se detectaron pacientes con hiporreninemia. Los indicadores de función renal se mantuvieron dentro de parámetros normales incluyéndose la creatinina de 0,76 ± 0,16 (mg/dL), el FENa24h de 0,6732 ± 0,23 (%), una FEK24h de 7.923 ± 3,1 (%) y microalbuminuria (MAC) de 10,89 ± 22,6 (ug/mL) (Tabla 2).
Los indicadores metabólicos muestran que el grupo total presentó un IMC de 28,03 ± 4,5 (kg/m2) con un 25% de obesos. Los niveles circulantes de adiponectina de 6,8 ± 3,9 (ug/mL) y de leptina de 13,1 ± 9,1 (ng/mL) fueron normales. Finalmente los marcadores de inflamación muestran que estos pacientes tienen niveles de PCRus de 3.474 ± 6,6 (mg/L) y de IL-17 plasmática de 7.883 ± 29,5 (pg/mL). Se observó que los niveles circulantes de aldosterona se asociaron negativamente con la edad (p < 0,001; rho = -0,02762) y negativamente FENa24h (p = 0,013; rho = -0,1825), pero no se asoció con los niveles plasmáticos de IL-17. A su vez la IL-17 no se asoció con ninguno de los parámetros plasmáticos tanto clínicos como bioquímicos como se observa en la Tabla 2.
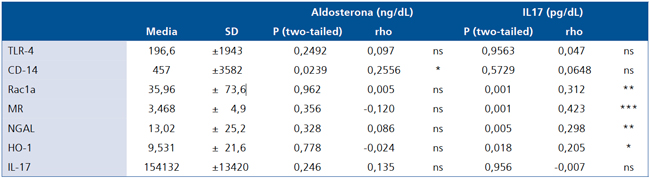
Los resultados de la expresión de los genes blanco en PBMCs y su asociación con aldosterona o IL17 plasmática se muestran en Tabla 3. Destaca, la asociación positiva entre aldosterona y la expresión de CD14 en estas células (p = 0,024; rho = 0,2556). Por otra parte, IL17 plasmática se asoció positivamente con Rac1a (p = 0,001; rho = 0,3124), MR (p = 0,001; rho = 0,423), NGAL (p = 0,005; rho = 0,248) y HO-1 (p = 0,018; rho = 0,2045).
Tabla 2. Datos antropométricos, bioquímicos y correlación entre los niveles plasmáticos de aldosterona o IL-17 de los pacientes con estas variables
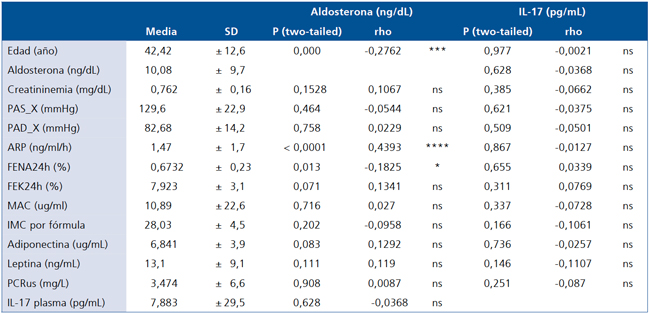
Tabla 3. Asociación de los niveles plasmáticos de aldosterona o IL-17 con marcadores proinflamatorios de los PBMC
Discusión
En este estudio encontramos que aldosterona no se asoció con los niveles plasmáticos de IL-17A en el grupo de pacientes estudiados, sin embargo, se asocia con la aparición de la expresión de CD-14 en células mononucleares circulantes. Por otro lado, IL-17A no se asoció a las variables antropométricas o bioquímicas medidas pero si lo hizo con la expresión de Rac-1a, MR y NGAL en los PBMC de estos sujetos, sugiriendo que ambas moléculas podrían modular diferentes vías de activación inmunológica de las células mononucleares.
Estudios previos de nuestro grupo han demostrado que tanto in vitro (DCs) como en ratones, la aldosterona indujo polarización a Th17, efecto que fue revertido por antagonistas de MR33,34. El mecanismo por el cual la aldosterona modula esta actividad en el sistema inmune no está descrito. En este trabajo encontramos que la aldosterona plasmática se asoció positivamente con la expresión de CD-14. Esta molécula es una proteína asociada a la señalización por TLR-4 frente a agentes patógenos y le proporciona una mejor sensibilidad a esta señalización49.
Paralelamente observamos en estos pacientes, no hipertensos, no obesos, que sus niveles de IL-17A plasmáticos se asocian positivamente con la expresión de RAC- 1a, MR, NGAL y HO-1 en PBMCs.
Pudiendo ser un marcador precoz del daño endotelialvascular, estudios previos57 demostraron que RAC-1, una GTPasa pequeña y componente de la NADPH oxidasa, es capaz de estimular directamente al MR en forma independiente de ligando y probablemente relacionado con el consumo de sal. Por otro lado, Latouche et al58, demostró que NGAL, una lipocalina relacionada al daño endotelial, que produce destrucción de la matriz extracelular, es un gen blanco del MR.
En nuestro estudio la señalización inducida por IL- 17A a través de su receptor, podría inducir, en un primer paso la expresión de MR, RAC-1A y HO-1 (Figura 1, paso A). Después de la traducción, esta GTPasa podría activarse por el consumo de sal o el estrés oxidativo celular y activar al MR en forma independiente de la aldosterona (Figura 1, paso B), induciendo la expresión de genes blancos del MR como NGAL, que produciría daño endotelial e inflamación (Figura 1, paso C). Nuestros resultados nos sugieren que los niveles plasmáticos de esta citoquina, IL-17, podría modular la activación de los mononucleares de manera dependiente de MR pero independiente de los niveles plasmáticos de aldosterona llevando a una inflamación subclínica, y posteriormente a daño endotelial e HTA.
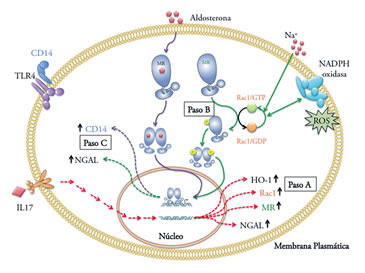 Figura 1. Mecanismos y efectos de Aldosterona e IL17 plasmáticos sobre activación de MR en PBMCs: Aldosterona e IL-17 activan vías paralelas e independientes para la activación de genes que participan en la actividad inmunogénica de los PBMC circulantes.
Figura 1. Mecanismos y efectos de Aldosterona e IL17 plasmáticos sobre activación de MR en PBMCs: Aldosterona e IL-17 activan vías paralelas e independientes para la activación de genes que participan en la actividad inmunogénica de los PBMC circulantes.
Por otro lado, como los niveles plasmáticos de IL-17 están relacionadas con las enfermedades autoinmunes59-61, el co-tratamiento de estas enfermedades con inhibidores del MR utilizando antagonistas de este receptor, cobraría importancia debido al gran incremento en las enfermedades autoinmunes.
Paralelamente, se ha encontrado que pacientes obesos presentan niveles elevados de aldosterona, asociados a disfunciones metabólicas62-64. Es conocido que la activación del MR puede gatillar fenómenos autoinmunes, alteración de la adipogénesis y de la insulino resistencia, acciones que van más allá del conocido aumento de la presión arterial descrito hace más de 50 años. En esta línea, nuestro grupo de estudio tiene un IMC promedio de 28 ± 4,5 kg/m2, categorizándose como una población con sobrepeso. Sin embargo, no se encontró una asociación entre el IMC y la aldosterona circulante. Tampoco se asoció aldosterona con los niveles de adiponectina ni con leptina, adipoquinas propias del tejido adiposo, lo que nos indica, que nuestros sujetos no presentan un desorden metabólico asociado a los niveles circulantes de aldosterona.
En resumen nuestro estudio mostró que en un grupo de estudio con antropometría y bioquímica consideró dentro de rangos normales, los niveles de aldosterona e IL-17 señalizarían por vías independientes y probablemente paralelas pudiendo ser sinérgicas en algunas patologías como el hiperaldosteronismo primario generando hipertension arterial y mayor daño vascular.
Referencias bibliográficas
- Fiebeler A, Muller DN, Shagdarsuren E, Luft FC. 2007. Aldosterone, mineralocorticoid receptors, and vascular inflammation. Curr Opin Nephrol Hypertens 16 (2): 134-142.
- Funder JW. 2006. Minireview: Aldosterone and the cardiovascular system: Genomic and nongenomic effects. Endocrinology p. 5564-5567.
- Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, et al. 2003. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension p. 1206-1252.
- Fardella CE, Mosso LM, Carvajal C. 2008. Hiperaldosteronismo primario. Rev Med Chile 136 (7): 905-914.
- Fardella C, Mosso L, Gómez-Sánchez C, Cortés P, Soto J, Gómez L, et al. 2000. Primary hyperaldosteronism in essential hypertensives: Prevalence, biochemical profile, and molecular biology. J Clin Endocrinol Metab 85: 1863-7.
- Lifton RP, Dluhy RG, Powers M, Rich GM, Gutkin M, Fallo F, et al. 1992. Hereditary hypertension caused by chimaeric gene duplications and ectopic expression of aldosterone synthase. Nat Genet 2 (1): 66-74.
- Mosso L, Carvajal C, González A, Barraza A, Ávila F, Montero J, et al. 2003. Primary aldosteronism and hypertensive disease. Hypertension 42: 161-165.
- Mulatero P, Stowasser M, Loh K-C, Fardella CE, Gordon RD, Mosso L, et al. 2004. Increased diagnosis of primary aldosteronism, including surgically correctable forms, in centers from five continents. J Clin Endocrinol Metab 89 (3) : 1045-1050.
- Müller-Fielitz H, Lau M, Jöhren O, Stellmacher F , Schwaninger M, Raasch W. 2012. Blood pressure response to angiotensin II is enhanced in obese Zucker rats and is attributed to an aldosterone-dependent mechanism. Br J Pharmacol 166 (8): 2417-2429.
- Simpson SA, Tait JF, Wettstein A, Neher R, Von Euw J, Reichstein T. 1953. Isolation from the adrenals of a new crystalline hormone with especially high effectiveness on mineral metabolism. Experientia 9 (9): 333-335.
- Sever R, Glass CK. Signaling by nuclear receptors. Cold Spring Harbor perspectives in biology. 2013.
- Horie-Inoue K, Takayama K, Bono HU, Ouchi Y, Okazaki Y, Inoue S. 2006. Identification of novel steroid tar get genes through the combination of bioinformatics and functional analysis of hormone response elements. Biochem Biophys Res Commun 339 (1): 99-106.
- Bhargava A, Pearce D. 2004. Mechanisms of mineralocorticoid action: determinants of receptor specificity and actions of regulated gene products. Trends Endocrinol Metab 15 (4): 147-153.
- Grossmann C, Ruhs S, Seiferth A, Gekle M. 2010. Interaction between mineralocorticoid receptor and cAMP/CREB signaling. Steroids. Elsevier Inc. 75 (8-9): 539-543.
- Náray-Fejes-Tóth A, Fejes-Tóth G. 2000. The sgk, an aldosteroneinduced gene in mineralocorticoid target cells, regulates the epithelial sodium channel. Kidney International p. 1290-1294.
- Derfoul A, Robertson NM, Lingrel JB, Hall DJ, Litwack G. 1998. Regulation of the human Na/K-ATPase beta1 gene promoter by mineralocorticoid and glucocorticoid receptors. J Biol Chem 273 (33): 20702-20711.
- Takeda Y. 2005. Role of Cardiovascular Aldosterone in Hypertension. Curr Med Chem Hematol Agents 3 (3): 261-266.
- Nagase M, Matsui H, Shibata S, Gotoda T, Fujita T. 2007. Salt-induced nephropathy in obese spontaneously hypertensive rats via paradoxical activation of the mineralocorticoid receptor: Role of oxidative stress. Hypertension 50 (5): 877-883.
- Nagase M, Shibata S, Yoshida S, Nagase T, Gotoda T, Fujita T. 2006. Podocyte injury underlies the glomerulopathy of Dahl salt-hypertensive rats and is reversed by aldosterone blocker. Hypertension 47 (6): 1084-1093.
- Nagase M. 2013. Role of Rac1 GTPase in salt-sensitive hypertension. CONH 22 (2): 148-155.
- Fujita T. 2010. Mineralocorticoid receptors, salt-sensitive hypertension, and metabolic syndrome. Hypertension p. 813-818.
- Tarjus A, Martínez-Martínez E, Amador C, Latouche C, El Moghrabi S, Berger T, et al. 2015. Neutrophil Gelatinase- Associated Lipocalin, a Novel Mineralocorticoid Biotar get, Mediates Vascular Profibrotic Effects of Mineralocorticoids. Hypertension 66 (1): 158-166.
- Muñoz-Durango N, González-Gómez LM, Vecchiola A, Simon F, Riedel CA, Fardella CE, et al. Modulation of Immunity and Inflammation by the Mineralocorticoid Receptor and Aldosterone. Biomed Res Int. Article ID 652738.
- Briet M, Schiffrin EL. 2011. The role of aldosterone in the metabolic syndrome. Curr Hypertens Rep 13 (2): 163-172.
- Thatcher S, Yiannikouris F, Gupte M, Cassis L. 2009. The adipose reninangiotensin system: role in cardiovascular disease. Mol Cell Endocrinol (302): 1 11-117.
- Funder JW. 2005. Mineralocorticoid receptors: Distribution and activation. Heart Fail Rev 10: 15-22.
- Herrada AA, Campino C, Amador CA, Michea LF, Fardella CE, Kalergis AM. 2011. Aldosterone as a modulator of immunity. J Hypertens 29: 1684-1692.
- Ehrhart-Bornstein M, Lamounier-Zepter V, Schraven A, Langenbach J, Willenberg HS, Barthel A, et al. 2003. Human adipocytes secrete mineralocorticoid-releasing factors. Proc Natl Acad Sci USA 100: 14211-14216.
- Usher MG, Duan SZ, Ivaschenko CY, Frieler RA, Berger S, Schütz G, et al. 2010. Myeloid mineralocorticoid receptor controls macrophage polarization and cardiovascular hypertrophy and remodeling in mice. J Clin Invest 120 (9): 3350-3364.
- Rickard AJ, Morgan J, Tesch G, Funder JW, Fuller PJ, Young MJ. 2009. Deletion of mineralocorticoid receptors from macrophages protects against deoxycorticosterone/salt-induced cardiac fibrosis and increased blood pressure. Hypertension 54: 537-543.
- Sica A, Mantovani A. 2012. Macrophage plasticity and polarization: In vivo veritas. Journal of Clinical Investigatio n p. 787-795.
- Kasal DA, Barhoumi T, Li MW, Yamamoto N, Zdanovich E, Rehman A, et al. 2012. T regulatory lymphocytes prevent aldosterone-induced vascular injury. Hypertension 59 (2): 324-330.
- Herrada AA, Contreras FJ, Marini NP, Amador CA, González PA, Cortés CM, et al. 2010. Aldosterone promotes autoimmune damage by enhancing Th17-mediated immunity. J Immunol 184 (1): 191-202.
- Amador CA, Barrientos V, Pena J, Herrada AA, González M, Valdés S, et al. 2014. Spironolactone decreases DOCA-saltinduced organ damage by blocking the activation of T helper 17 and the downregulation of regulatory T lymphocytes. Hypertension. 2014/01/15 ed. 63 (4): 797-803.
- Gaffen SL. 2009. Structure and signalling in the IL-17 receptor family. Nat Rev Immunol. Nature Publishing Group 9 (8): 556-567.
- Mills KHG. 2008. Induction, function and regulation of IL-17- producing T cells. Eur J Immunol 38 (10): 2636-2649.
- Nitta T, Muro R, Shimizu Y, Nitta S, Oda H, Ohte Y, et al. 2015. The thymic cortical epithelium determines the TCR repertoire of IL-17 producing cd T cells 16 (5): 638-654.
- Ji Y, Liu J, Wang Z, Liu N. 2009. Angiotensin II induces inflammatory response partly via toll-like receptor 4-dependent signaling pathway in vascular smooth muscle cells. Cell Physiol Biochem 23 (4-6): 265-276.
- Liu N, Liu J, Ji Y, Lu P. 2010. Toll-like receptor 4 signaling mediates inflammatory activation induced by C-reactive protein in vascular smooth muscle cells. Cell Physiol Biochem 25 (4-5): 467-476.
- Liu-Bryan R, Scott P, Sydlaske A, Rose DM, Terkeltaub R. 2005. Innate immunity conferred by Toll-like receptors 2 and 4 and myeloid differentiation factor 88 expression is pivotal to monosodium urate monohydrate crystal-induced inflammation. Arthritis Rheum 52 (9): 2936-2946.
- De Graaf R, Kloppenburg G, Kitslaar PJHM, Bruggeman CA, Stassen F. 2006. Human heat shock protein 60 stimulates vascular smooth muscle cell proliferation through Toll-like receptors 2 and 4. Microbes Infect 8 (7): 1859-1865.
- Asea A, Rehli M, Kabingu E, Boch JA, Baré O, Auron PE, et al. 2002. Novel signal transduction pathway utilized by extracellul ar HSP70. Role of toll-like receptor (TLR) 2 and TLR4. J Biol Chem 277 (17): 15028-150234.
- Feig DI, Soletsky B, Johnson RJ. 2008. Ef fect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA 300 (8): 924-932.
- Thompson JA, Webb RC. 2013. Potential role of Toll-like receptors in programming of vascular dysfunction. Clin Sci (Lond) 125 (1): 19-25.
- Lewington S, Clarke R, Qizilbash N, Peto R, Collins R. 2002. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 360 (9349): 1903-1913.
- Stier CJ, Chander PRR. 2002. Aldosterone as a mediator in cardiovascular injury. Cardiol Rev. (10): 97-107.
- Freel E, Connell J. 2004. Mechanisms of hypertension: the expanding role of aldosterone. J Am Soc Nephrol 15 (8): 1993-2001.
- Krysiak R, Okopien B. 2012. The effect of treatment on monocyte and lymphocyte cytokine release in patients with aldosteronoma. Hypertens Res (35): 123-125.
- Zanoni I, Granucci F. 2013. Role of CD14 in host protection against infections and in metabolism regulation. Front Cell Infect Microbiol 3 (July): 32.
- Village G. 2004. The Fourth Report on the Diagnosis, Evaluation, and Treatment of High Blood Pressure in Children and Adolescents. Pediatrics 114: 555-576.
- Carvajal CA, Campino C, Martínez-Aguayo A, Tichauer JE, Bancalari R, Valdivia C, et al. 2012. A new presentation of the chimeric CYP11B1/CYP11B2 gene with low prevalence of primary aldosteronism and atypical gene segregation pattern. Hypertension 59: 85-91.
- Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method. Methods 25 (4): 402-408.
- Cockcroft DW, Gault MH. 1976. Prediction of creatinine clearance from serum creatinine. Nephron. SWITZERLAND 16 (1): 31-41.
- Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, et al. 1996. Serum immunoreactiveleptin concentrations in normal-weight and obese humans. N Engl J Med 334 (5): 292-295.
- K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. United States; 2002; 39 (2 Suppl 1): S1-266.
- Silkensen JR, Kasiske BL. 2004. Laboratory assessment of renal disease: Clearence, urinalysis, and renal biopsy. In: Brenner BM, editor. Brenner an Rector ’s The Kidney. 7th ed. Philadelphia: Saunders p. 1107-1150.
- Kawarazaki H, Ando K, Shibata S, Muraoka K, Fujita M, Kawarasaki C, et al. 2012. Mineralocorticoid receptor-Rac1 activation and oxidative stress play major roles in salt-induced hypertension and kidney injury in prepubertal rats. J Hypertens 30 (10): 1977-1985.
- Latouche C, El Moghrabi S, Messaoudi S, Cat AND, Hernández- Díaz I, De La Rosa DA, et al. 2012. Neutrophil gelatinaseassociated lipocalin is a novel mineralocorticoid target in the cardiovascular system. Hypertension 59 (5): 966-972.
- Matsuki T, Nakae S, Sudo K, Horai R, Iwakura Y. 2006. Abnormal T cell activation caused by the imbalance of the IL-1/ IL-1R antagonist system is responsible for the development of experimental autoimmune encephalomyelitis. Int Immunol 18 (2): 399-407.
- Sutton C, Brereton C, Keogh B, Mills KH, Lavelle EC. 2006. A crucial role for interleukin (IL)-1 in the induction of IL-17- producing T cells that mediate autoimmune encephalomyelitis. J Exp Med 203 (7): 1685-1691.
- Yen D, Cheung J, Scheerens H, Poulet F , McClanahan T, McKenzie B, et al. 2006. IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6. J Clin Invest 116 (5): 1310-1316.
- Vaidya A, Underwood PC, Hopkins PN, Jeunemaitre X, Ferri C, Williams GH, et al. 2013. Abnormal aldosterone physiology and cardiometabolic risk factors. Hypertension 61 (4): 886-93.
- Harada E, Mizuno Y, Katoh D, Kashiwagi Y, Morita S, Nakayama Y, et al. 2013. Increased urinary aldosterone excretion is associated with subcutaneous not visceral, adipose tissue area in obese individuals: A possible manifestation of dysfunctional subcutaneous adipose tissue. Clin Endocrinol (Oxf) 79 (4): 510-6.
- Fallo F, Veglio F, Bertello C, Sonino N, Mea P Della, Ermani M, et al. 2015. Prevalence and Characteristics of the Metabolic Syndrome in Primary Aldosteronism 91 (May): 454-9.