Utilidad diagnóstica de la ecografía tiroidea en la evaluación de nódulos tiroideos en niños y adolescentes
Paula Rojas G.1,2, Andrés Retamal C.3, Lizbeth Pérez M.4, Alex Castro M.5, Andrea Huneeus V.2 y Eleonora Horvath P.4
Diagnostic utility of thyroid ultrasound ecografy in thyroid nodules evaluation in children and adolescents
1Unidad de Endocrinología, Departamento de Medicina Interna, Clínica Alemana de Santiago.
2Centro de Adolescencia, Departamento de Pediatría, Clínica Alemana de Santiago.
3Residente Radiología Pediátrica, Departamento de Radiología, Clínica Alemana de Santiago.
4Departamento de Radiología, Clínica Alemana de Santiago.
Correspondencia:
Paula Rojas Goñi
San Carlos de Apoquindo 746.
Las Condes, Santiago.
projas@alemana.cl
Recibido: 12-09-2017
Aceptado: 09-11-2017
Aim: To evaluate the diagnostic utility of ultrasonography and other antecedents and exams usually availables, in the study of patients with thyroid nodules aged 0-20 years. Subjects and methodology: Cross-sectional analytical observational study. We reviewed the data of patients undergoing FNAP (thyroid puncture with a fine needle) and / or thyroidectomy between January 2007 and December 2013. The ultrasound evaluation was performed by 3 specialists. The surgical biopsy was considered an indicator of benignity or malignancy and, in its absence the FNAP (excluding the Bethesda diagnoses 3 and 4). The association between cancer and the different variables was evaluated through binary logistic regression, with measure of association of odds ratio (OR). With the initially significant variables, a multivariate analysis was carried out and a cut-off score was subsequently defined to allow the diagnosis to be discriminated. Results: 104 nodules are included in the analysis (100 patients), 89♀ / 11♂; age x16 ± 2.8; TSH 2.8 uIU / ml ± 5; lymphocytic thyroiditis 30%; pathological anatomy: benign 46 (44%) cancer 58 (56%). Sonographic findings predictive of malignancy were: hypoechogenicity (OR 2.95 p = 0.008) irregular shape (100% CA) non-smooth edges (OR 8.5 p = 0.000) microcalcifications (OR 39 p = 0.000) thick calcifications (OR 18 p = 0.001) and presence of suspicious adenopathy (100% CA). In the TIRADS classification, cases classified as 4 and 5 corresponded to cancer in 50 and 92%. The presence of thyroiditis did not show an insignificant association with malignancy. From the joint analysis of the significant variables, a score with adequate sensitivity and specificity is obtained. Conclusions: The usefulness of ultrasound as a fundamental examination in the evaluation of the pediatric patient who consults by thyroid nodule is corroborated. Accurately describing their sonographic characteristics and, above all, analyzing them together, allows us to determine an approximate risk of malignancy and define with greater certainty the indication of performing FNAP.
Key words: Thyroid nodule; Thyroid ultrasound; Thyroid cancer diagnosis.
La prevalencia de nódulos tiroideos palpables en niños y adolescentes se reporta históricamente en 1,8%1. El uso frecuente de la ecografía cervical ha aumentado significativamente su diagnóstico en los últimos años por lo que hoy constituye un motivo de consulta relativamente habitual2,3. El principal problema diagnóstico es determinar el riesgo de malignidad en cada caso. La posibilidad de que un nódulo tiroideo resulte ser cáncer, en este grupo etario, se describe de un 22 a 43%4-6, más alta que en adultos donde es de 7-15%7.
A pesar de que algunos antecedentes clínicos y exámenes iniciales de laboratorio pueden sugerir mayor riesgo de malignidad8-11 los principales métodos diagnósticos son la ecografía y la punción aspirativa con aguja fina (PAAF)12,13.
Es conocido el rol de la ecografía tiroidea como un examen útil en el estudio de un nódulo tiroideo14. Es un método de alto rendimiento, no invasivo y de bajo costo por lo que es clave en la evaluación inicial. La clasificación TIRADS, descrita por Horvath en adultos15,16, busca integrar en un score único estos diferentes patrones ecográficos, entregando información sobre el riesgo de malignidad de un determinado nódulo.
En niños y adolescentes se ha reportado asociación de cáncer con hipoecogenicidad, forma del nódulo más alta que ancha, presencia de microcalcificaciones y linfonodos patológicos17.
La PAAF se considera actualmente el examen de mayor certeza diagnóstica, pues permite el estudio anatomopatológico, sin embargo, es un procedimiento invasivo y de mayor costo que requiere de equipos especializados, por lo que los pacientes deben ser cuidadosamente seleccionados. Su indicación ha sido revisada por varios autores considerando la dificultad práctica de realizar el procedimiento a esta edad y una aparente menor sensibilidad de los resultados que lo descrito en adultos18-21.
Nos interesó conocer la situación de esta patología en nuestro centro, investigar la asociación de hallazgos clínicos y ecográficos con el diagnóstico de malignidad y determinar su utilidad para orientar al endocrinólogo en la evaluación de los pacientes de este grupo etario.
Material y Método
Estudio observacional analítico de corte transversal, realizado en Clínica Alemana de Santiago. Se revisaron los antecedentes clínicos y ecográficos de todos los pacientes de 0-21 años con diagnóstico de nódulo tiroideo que fueron sometidos a PAAF y/o tiroidectomía en nuestro centro entre enero de 2007 y diciembre de 2013. En caso de bocio multinodular se analizó por separado cada nódulo que contaba con estudio anatomopatológico.
De los antecedentes clínicos se consignó edad, género, valor de hormona tiroestimulante (TSH) y presencia o no de tiroiditis de Hashimoto. El diagnóstico de tiroiditis de Hashimoto se estableció por el informe anatomopatológico de tiroiditis linfocitaria en los pacientes operados o por anticuerpos anti tiroglobulinas en títulos significativos y ecografía sugerente en los pacientes no operados.
La descripción de las imágenes ecográfica fue realizada en forma ciega al diagnóstico anatomopatológico por una radióloga pediátrica en los pacientes menores de 15 años (LP) y por una radióloga de adultos en los pacientes ≥ a 15 años (EH, especialista en ecografía tiroidea). Se analizaron las siguientes variables: tamaño, estructura (sólido/quístico/mixto), ecogenicidad (hipoecogénico/iso-hiperecogénico), bordes (lisos/no lisos), forma (circular/ovalado/irregular/multilobulado), cápsula (ausente/completa/incompleta) vascularización (ausente/pobre/moderada/marcada), calcificaciones (microcalcificaciones/calcificaciones gruesas/sin calcificaciones), ganglios sospechosos (tamaño aumentado/forma redondeada/microcalcificaciones/pérdida de hilio central). También fue evaluada la categoría TIRADS de acuerdo a lo descrito15.
Para definir cada nódulo como benigno o maligno se utilizó el informe final de la biopsia quirúrgica. En aquellos pacientes que no fueron operados se consideró el resultado de la PAAF, excluyendo del análisis los diagnósticos indeterminados Bethesda 3 y 421.
Análisis
La asociación entre cáncer y las diferentes variables estudiadas fue evaluada a través de regresión logística binaria, con medida de asociación de odds ratio (OR). Los intervalos de confianza fueron del 95% y se utilizó significación del 5%.
Con las variables que inicialmente resultaron significativamente asociadas a cáncer se realizó un análisis multivariado y posteriormente se definió un puntaje de corte que permitiera discriminar el diagnóstico, dicho puntaje se logró sumando el OR respectivo si la característica estaba presente en el nódulo. La calidad de discriminación se evaluó mediante el área bajo la curva ROC, proponiéndose un punto de corte que lograra una adecuada sensibilidad y especificidad al evento de malignidad del nódulo.
Los datos fueron procesados en programa STATA versión 14.0
El estudio fue aprobado por el comité de ética y la unidad de investigación y ensayos clínicos de Clínica Alemana de Santiago.
Resultados
Se identificó inicialmente a 124 pacientes, de los cuales 24 fueron eliminados del estudio (17 por no contar con la información requerida y 7 por resultado de la PAAF no concluyente, Bethesda III y IV); en definitiva se incorporaron al estudio 104 nódulos tiroideos, correspondientes a 100 pacientes. 46 nódulos (44%) fueron benignos y 58 malignos (56%). El diagnóstico anatomopatológico fue por biopsia quirúrgica en 72 y PAAF en 32 nódulos. Los diagnósticos malignos fueron cáncer papilar clásico 81%, cáncer papilar variedad folicular 6%, cáncer papilar otros subtipos histológicos 11% y cáncer medular en 1 caso.
La Tabla 1 corresponde a la descripción de la muestra. La edad, género y valor de TSH no se asoció significativamente al diagnóstico de cáncer. El diagnóstico de tiroiditis de Hashimoto mostró un OR de 2,3 (IC 95% 0,9-5,7) que no fue significativo (p = 0,06).
En cuanto a los hallazgos ecográficos el tamaño, la vascularización y las características de la cápsula no mostraron asociación significativa. En el análisis univariado se encontró la mayor asociación en: presencia de microcalcificaciones OR 39 (IC 95% 11-134), calcificaciones gruesas OR 18 (IC 95% 3,3-97), estructura sólida OR 15 (IC95% 5-44), bordes no lisos OR 8,5 (IC 95% 2,7-27) e hipoecogenicidad OR 2,9 (IC 95% 1,3-6,5). El hallazgo de adenopatía sospechosa se asoció a malignidad en el 100% de los casos. Características asociadas a benignidad fueron estructura quística 100% de los casos, estructura mixta OR 0,5 (IC95% 0,01-0,1) y forma ovalada OR 0,3 (IC95% 0,1-0,8).
Para calcular el puntaje se sumó el respectivo OR aproximado al entero superior si la presencia de la característica ecográfica está presente, es decir, usando la siguiente ecuación:
Puntaje = 3*hipoecogenicidad + 7*estructura sólida + 5*bordes no lisos + 24*microcalcificaciones + 21*macrocalcificaciones.
De este modo se construyó la distribución del puntaje por condición de malignidad. La Tabla 3 muestra las estadísticas de clasificación para los distintos puntos del puntaje (sensibilidad, especificidad, clasificación correcta, likelihood ratio positivo y negativo).
De acuerdo a esta tabla nos parece interesante observar que un punto de corte de ≥ 15 en el valor del puntaje, muestra una sensibilidad de 87,9% y especificidad de 84,8% para el diagnóstico de malignidad. Con fines prácticos habría que decir que este valor se obtiene si el nódulo reúne las características de estructura sólida + hipoecogenicidad + bordes no lisos, en tanto que la presencia de microcalcificaciones o macrocalcificaciones por si solas ya alcanzan ese puntaje.
El área bajo la curva ROC fue de 93,3% (IC 88,6- 97,7) que según el criterio de Hosmer-Lemeshow está en el rango de clasificación “excelente”22.
Al evaluar la clasificación TIRADS se obtiene que en los casos catalogados como 4 y 5 se encuentra malignidad en un 50 y 92% respectivamente. El hallazgo de nódulos TIRADS 2 es muy bajo en nuestra muestra (4 casos), lo cual se explica porque habitualmente en los nódulos TIRADS 2 no se realiza PAAF ni cirugía. De este grupo hubo un nódulo que resultó maligno (25%). En aquellos informados como TIRADS 3 el 100% fueron benignos.
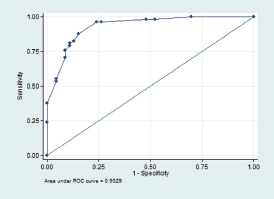
Tabla 1. Variables demográficas y ecográficas totales y comparación entre grupos de
|
Total (104) |
Benigno (46) |
Cáncer (58) |
OR ( 95% IC) |
p value |
Edad (años x ± DS) |
16,7 ± 2 |
16,2 ± 2 |
17 ± 2 |
1,1 (0,9-1,2) |
0,17 |
Género (F/M) |
88/12 |
37/7 |
51/5 |
|
|
TSH (uUI/ml x ± DS) |
2,8 ± 5 |
1,6±1 |
3,4 ± 6 |
1,08 (0,8-1.3) |
0,47 |
T Hashimoto (%) |
30 (28) |
9 |
21 |
2,3 (0,9-5,7) |
0,06 |
Características ecográficas |
|
|
|
|
|
Tamaño (mm x ± DS) |
15 ± 10 |
17,6 ± 10 |
13 ± 9 |
0,9 (0,9-1) |
0,054 |
Estructura sólida (%) |
72 (73) |
19 |
53 |
15 (5-44) |
0,000 |
Hipoecogenicidad (%) |
56 (54) |
18 |
38 |
2,9 (1,3-6,5) |
0,008 |
Forma irregular (%) |
9 (8) |
0 |
9 |
|
|
Bordes no lisos (%) |
30 (29) |
4 |
26 |
8,5 (2,7-27) |
0,000 |
Microcalcificaciones (%) |
43 (41) |
4 |
39 |
39 (11-134) |
0,000 |
Macrocalcificaciones (%) |
11 (11) |
2 |
9 |
18 (3,3-97) |
0,001 |
Adenopatías (%) |
19 (18) |
0 |
19 |
|
|
Estructura quística (%) |
2 (2) |
2 |
0 |
|
|
Estructura mixta (%) |
30 (29) |
25 |
5 |
0,5 (0,01-0,2) |
0,000 |
Forma ovalada (%) |
54 (52) |
32 |
22 |
0,3 (0,1-0,8) |
0,02 |
Tabla 2. Resultado de análisis multivariado de características ecográficas seleccionadas
|
OR |
p value |
Intervalo de confianza 95% |
|
Hipoecogenicidad |
2,53 |
0,153 |
0,71 |
9,05 |
Estructura sólida |
6,77 |
0,006 |
1,74 |
26,37 |
Bordes no lisos |
4,81 |
0,064 |
0,91 |
25,45 |
Microcalcificaciones |
23,6 |
0,000 |
5,94 |
93,70 |
Macrocalcificaciones |
20,93 |
0,004 |
2,72 |
161,31 |
Tabla 3. Estadísticas de clasificación para los distintos puntos del puntaje
Punto de corte puntaje (≥) |
Sensibilidad |
Especificidad |
Bien clasificados |
LR+ |
LR- |
3 |
100,0 |
30,4 |
69,2 |
1,4 |
0,0 |
5 |
98,3 |
47,8 |
76,0 |
1,9 |
0,0 |
7 |
98,3 |
52,2 |
77,9 |
2,1 |
0,0 |
8 |
96,6 |
73,9 |
86,5 |
3,7 |
0,0 |
10 |
96,6 |
76,1 |
87,5 |
4,0 |
0,0 |
15 |
87,9 |
84,8 |
86,5 |
5,8 |
0,1 |
21 |
82,8 |
87,0 |
84,6 |
6,3 |
0,2 |
24 |
81,0 |
89,1 |
84,6 |
7,5 |
0,2 |
27 |
79,3 |
89,1 |
83,7 |
7,3 |
0,2 |
28 |
75,9 |
91,3 |
82,7 |
8,7 |
0,3 |
31 |
70,7 |
91,3 |
79,8 |
8,1 |
0,3 |
33 |
55,2 |
95,7 |
73,1 |
12,7 |
0,5 |
34 |
53,5 |
95,7 |
72,1 |
12,3 |
0,5 |
36 |
37,9 |
100,0 |
65,4 |
|
0,6 |
Discusión
Esta investigación aporta información de interés en relación al estudio diagnóstico de los nódulos tiroideos en población pediátrica. Se confirma para este grupo etario lo publicado previamente en adultos de que la ecografía es el examen de mayor importancia en la evaluación inicial de los nódulos tiroideos. Otros elementos que han sido considerados por algunos autores asociados a mayor riesgo de cáncer como TSH elevada, sexo masculino y presencia de tiroiditis de Hashimoto no mostraron asociación significativa a malignidad en la población por nosotros estudiada.
En relación a los hallazgos de la ecografía encontramos que la presencia en el nódulo de alguna de las siguientes características: estructura sólida, hipoecogenicidad, bordes irregulares, micro o macrocalcificaciones se asocia a mayor riesgo de malignidad. También se debe destacar la existencia de adenopatías sospechosas en los compartimientos cervicales, ya que en nuestros resultados este hallazgo se asoció a cáncer en todos los casos. Por el contrario, la ausencia de estas características en el nódulo, así como el tener estructura quística o mixta se asoció a benignidad, lo que permitiría en la mayoría de los casos evitar la PAAF y plantear el seguimiento ecográfico como herramienta de manejo.
Nuestros resultados iniciales plantean que el análisis conjunto de aquellas características que mostraron mayor asociación a malignidad expresada como un puntaje, permitiría conocer con bastante precisión la posibilidad de malignidad del nódulo en evaluación. Este resultado novedoso requiere ser validado por estudios posteriores que incluyan mayor número de pacientes y de evaluadores.
Con respecto a la evaluación TIRADS, podemos decir que los resultados obtenidos son bastante semejantes a lo descrito por Horvath en población adulta15,16 por lo que se puede postular como una herramienta también de gran utilidad para aplicar en población pediátrica.
Planteamos como las principales limitantes de este estudio: a) el sesgo que determina que el grupo evaluado corresponde sólo a nódulos que tienen análisis anatomopatológico (PAAF o biopsia quirúrgica) y, por lo tanto, estos resultados no pueden ser totalmente extrapolados a la población general de pacientes que acuden para una evaluación inicial; b) que no hay una información precisa respecto al seguimiento clínico de los nódulos cuya punción fue benigna.
Consideramos que nuestros hallazgos corroboran la utilidad de la ecografía como el examen fundamental en la evaluación inicial del paciente pediátrico que consulta por el hallazgo de enfermedad nodular de tiroides. El describir con precisión sus características ecográficas y sobre todo analizarlas en conjunto nos permiten determinar un riesgo aproximado de malignidad y de esta forma definir con mayor certeza la indicación de realizar la PAAF para complementar su estudio.
Agradecimientos
Agradecemos a la unidad de ensayos clínicos de Clínica Alemana, en especial al Dr. Cristóbal Carvajal por su apoyo en la recopilación y ordenamiento de los datos y al Sr. Gabriel Cavada por su colaboración en el análisis estadístico.
Referencias bibliográficas
- Rallison ML, Dobyns BM, Meikle AW, Bishop M, Lyon JL, Stevens W. 1991. Natural History of Thyroid Abnormalities: Prevalence, incidence, and regression of thyroid diseases in adolescents and young adults. Am J Med 91:363-70.
- La Franchi S. 2017. Thyroid nodules and cancer in children. En: UpTpDate, Ross DS, Geffner ME (Ed), UpToDate, Whaltman.
- Avula S, Daneman A, Navarro OM, Moineddin R, Urbach S, Daneman D. 2010. Incidental thyroid abnormalities identified on neck US for non-thyroid disorders. Pediatr Radiol 40: 1774-80.
- Canadian Pediatric Thyroid Nodule (CaPTN) Study Group. 2008.The Canadian Pediatric Thyroid Nodule Study: an evaluation of current management practices. Journal of pediatric surgery 43: 826-30.
- Niedzela M. 2006. Pathogenesis, diagnosis and management
of thyroid nodules in children. Endocrine-related cancer 13:
427-453.
- Gupta A, Ly S, Castroneves LA, Frates MC, Benson CB, Feldman HA, et al. 2013. A standardized assessment of thyroid nodules in children confirms higher cancer prevalence than in adults. J Clin Endocrinol Metab 98: 3238-45.
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2016. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 26: 1-133.
- Bonora E, Tallini G, Romeo G. 2010. Genetic Predisposition to Familial Nonmedullary Thyroid Cancer: An Update of Molecular Findings and State-of-the-Art Studies. Journal of Oncology, Article ID 385206, 7 pages, 2010. doi:10.1155/2010/385206.
- Taylor AJ, Croft AP, Palace AM, Winter DL, Reulen RC, Stiller CA, Stevens MC, et al. 2009. Risk of thyroid cancer in survivors of childhood cancer: results from The British Childhood Cancer Survivor Study. Int J Cancer 125 (10): 2400-2405.
- Corrias A, Cassio A, Weber G, Mussa A, Wasniewska M, Rapa A, Gastaldi R, et al; Study Group for Thyroid Diseases of Italian Society for Pediatric Endocrinology and Diabetology (SIEDP/ISPED). 2008. Thyroid nodules and cancer in children and adolescents affected by autoimmune thyroiditis. Arch Pediatr Adolesc Med 162 (6): 526-531.
- Chiu HK, Sanda S, Fechner PY, Pihoker C. 2012. Correlation of TSH with the risk of paediatric thyroid carcinoma. Clin Endocrinol (Oxf) 77: 316-22.
- Hanley P, Lord K, Bauer AJ. 2016. Thyroid Disorders in Children and Adolescents: A Review. JAMA Pediatr 1; 170 (10): 1008-1019. doi: 10.1001/jamapediatrics.2016.0486. PubMed PMID: 27571216.
- Bauer AJ, Francis GL. 2016. Evaluation and management of thyroid nodules in children. Curr Opin Pediatr 28 (4): 536-544.
- Domínguez JM, Baudrand R, Cerda J, Campusano C, Fardella C, Arteaga E, et al. 2011. An ultrasound model to discriminate the risk of thyroid carcinoma. Acad Radiol 18 (2): 242-245.
- Horvath E, Majlis S, Rossi R, Franco C, Niedmann JP, Castro A, et al. 2009. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab 94:1748-51.
- Horvath E, Silva CF, Majlis S, Rodríguez I, Skoknic V, Castro A, et al. 2016. Prospective validation of the ultrasound based TIRADS (Thyroid Imaging Reporting And Data System) classification: results in surgically resected thyroid nodules. Eur Radiol [Epub ahead of print] PubMed PMID: 27718080.
- Goldfarb M, Gondek SS, Sánchez Y, Lew JI. 2012. Clinic-Based Ultrasound Can Predict Malignancy in Pediatric Thyroid Nodules. Thyroid 22: 827-31.
- Corrias A, Mussa A. 2013. Thyroid nodules in pediatrics: Witch Ones can be left alone, which ones must be Investigated, When and How. J Clin Pediatr Endocrinol 5 (Suppl 1): 57-69.
- Amirazodi E, Propst EJ, Chung CT, Parra DA, Wasserman JD. 2016. Pediatric thyroid FNA biopsy: Outcomes and impact on management over 24 years at a tertiary care center. Cancer 124 (11): 801-810.
- Stevens C, Lee JK, Sadatsafavi M, Blair GK. 2009. Pediatric Thyroid Fine-needle Aspiration Cytology: A meta-analysis. J Pediatric Surgery 44: 2184-2191.
- Cibas E, Syed A. 2009. The Bethesda System for Reporting Thyroid Cytopathology. Am J Clin Pathol 132: 658: 65.
- Applied Logostic Regression. Second edition Editorial John Willey & Sons, año 2000, pag 162.