Timo persistente y su implicancia en el seguimiento del cáncer diferenciado del tiroides
Carolina Martínez C.1 y José M. López M.2
Abnormal mediastinal radioiodine uptake due to persistent thymus. Report of one case
1Residente Becario de Endocrinología. Escuela de Medicina, Pontifi cia Universidad Católica de Chile.
2Departamento de Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia a: Carolina Martínez C. Departamento de Endocrinología. Facultad de Medicina, Pontifi cia Universidad Católica de Chile. Lira 85, 5º piso. Santiago, Chile. Teléfono 3543095. Fax: 6385675.
E-mail: kalumartinez@gmail.com
No hay confl ictos de interés. No requirió fi nanciamiento
Recibido: 26 Enero de 2009
Aceptado: 19 Febrero de 2009
We report a 37 years old female operated for a multifocal papillary thyroid carcinoma. During her follow up, mediastinal uptake of radioiodine due to a persistent thymus, was detected. This is a situation may cause a false positive uptake of radioiodine that may be interpreted as a tumor relapse or metastasis.
Key words: Differentiated thyroid cancer, whole-body 131-I scan, thymus 131-I uptake.
El tratamiento del cáncer diferenciado del tiroides requiere de tiroidectomía total y I131 en dosis variables según las características biológicas y el compromiso y extensión anatómica del tumor operado. En el seguimiento de estos pacientes el rastreo cervical y corporal, buscando captación anómala del isótopo, es una herramienta de uso frecuente en individuos de alto riesgo, e ineludible cuando la concentración de tiroglobulina está aumentada. La concomitancia de tiroglobulina positiva, espontánea o estimulada por TSH (endógeno o recombinante) y captación anómala de yodo radioactivo, plantea los diagnósticos de remanente tiroideo, recidiva, persistencia tumoral o metástasis. Cuando se da la situación de captación positiva de I131 en ausencia de concentraciones plasmáticas detectables de tiroglobulina bajo condición de estímulo con TSH, se requiere de medidas diagnósticas adicionales como la tomografía computada, resonancia magnética, tomografía de emisión de positrones o el estudio histológico de la lesión, si ella es abordable. Dentro de este contexto, la captación anómala del isótopo localizada en la región mediastínica anterior y superior plantea la posibilidad de persistencia de tejido tiroideo intratorácico remanente a la operación, ya sea tumoral o no, o metástasis ganglionares mediastínicas. Estos diagnósticos implican replantear una segunda cirugía y/o una segunda dosis de I131, dependiendo de la magnitud y características de los hallazgos y del genio biológico del tumor operado.
Sin embargo, en acuerdo con la validez de lo expresado anteriormente, no debe olvidarse que existen causas espurias que también pueden explicar la detección anómala de I131 en el rastreo. Ellas son variadas y corresponden a situaciones tanto normales como patológicas; algunas se deben a captaciones del isótopo, en el sentido real de la palabra, y otras a acumulaciones de líquidos (saliva u otros) que contienen I131 (Tabla 1).
Comunicamos el caso de una mujer adulta, operada de cáncer papilar multifocal del tiroides con metástasis ganglionares cervicales, en cuyo seguimiento se detectó captación de yodo radioactivo a nivel mediastínico. Los planteamientos diagnósticos ante este hallazgo constituyen la razón de su presentación.
Caso Clínico
Mujer que a los 37 años de edad le fue diagnosticado un cáncer papilar de tiroides. La ecografía tiroidea inicial mostró un nódulo de 13,4 mm de diámetro en lóbulo derecho (LTD), heterogéneo, hipoecogénico, de márgenes irregulares, con microcalcifi caciones, y además, dos nódulos de características benignas en lóbulo izquierdo (LTI) de 5 y 8 mm. La punción aspirativa con aguja fina del nódulo derecho confirmó que se trataba de un carcinoma papilar del tiroides. Se efectuó tiroidectomía total; el estudio histológico describió cáncer papilar del tiroides, multifocal (un foco en LTD de 12 mm y 2 focos en LTI de 10 y 3 mm), variedad folicular, infiltrante hasta la cápsula en ambos lóbulos, con extensión al tejido adiposo peritiroideo y permeación vascular. Además, cuatro de diez ganglios del grupo VI izquierdo presentaban compromiso metastásico tumoral. Post cirugía recibió 200 mCI de I131; inmediatamente antes de esa dosis terapéutica tenía TSH: 54,2 uUI/mL, tiroglobulina (Tg): 35,4 ng/dL con negatividad de los anticuerpos anti tiroglobulina (Ac antiTg). La exploración sistémica post I131 mostró dos zonas confluentes de captación del radiofármaco alineadas en posición paramediana derecha y baja del cuello y una pequeña zona de menor intensidad en el lecho tiroideo derecho (Figura 1). Estos hallazgos fueron interpretados como metástasis ganglionares del grupo VI y un pequeño remanente tiroideo.
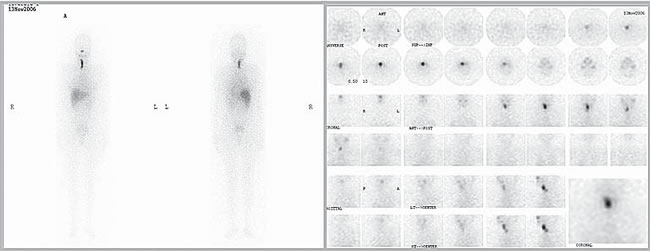
Figura 1. Exploración sistémica post tratamiento con I131 (200 mCi) con captación cervical positiva.
Se inició tratamiento con L-tiroxina (Eutirox®) en dosis ascendentes hasta llegar a 150 mcg/d (TSH: 0,06 uUI/mL). Al completar un año de operada, la ecografía cervical fue totalmente negativa, pero la Tg estimulada fue 8,7 ng/mL (TSH: 64 uUI/mL) con negatividad de los Ac anti Tg. Después de una segunda dosis de 100 mCi de I131, el rastreo sistémico sólo mostró un leve aumento en la captación de I131 en línea media baja, en situación retro esternal (Figura 2). El hallazgo descrito correspondía a captación mediastínica. En el control a los 18 meses, la Tg (sin estímulo) era indetectable (< 0,5 ng/mL), persistiendo la negatividad de los Ac anti Tg. Al completar el segundo año de seguimiento, la ecografía cervical no mostró ningún hallazgo patológico. Dado el antecedente de captación cervical baja, se solicitó un TAC cervical y torácico que mostró un lecho tiroideo libre y ausencia de adenopatías; en el mediastino superior, se describe una imagen triangular en el espacio prevascular, que se interpretó como persistencia del timo (Figura 3).
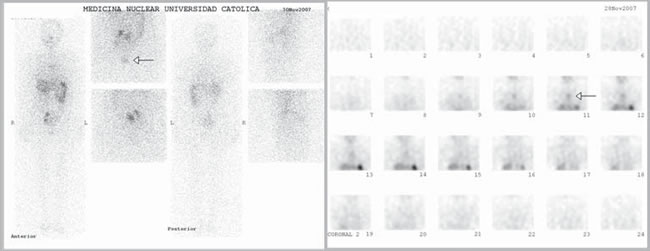
Figura 2. Exploración sistémica post segunda dosis de I131 (100 mCi), con captación intratorácica. La fl echa señala la imagen del timo.
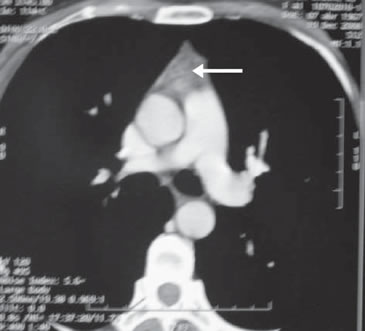
Figura 3. Tomografía computada de tórax mostrando la presencia de timo.
Discusión
Este caso ejemplifica como, en situaciones como la descrita, se está proclive a interpretar la captación cervical anterior baja del isótopo como parte de la enfermedad tumoral, más aún si el genio biológico del tumor es agresivo, como sucedió en nuestra paciente, y asociado a Tg positiva (8 ng/mL). Sin embargo, en el control efectuado a los dos años de la cirugía, y habiendo recibido dos dosis de yodo radioactivo, la ausencia de hallazgos ecográficos, y la negatividad de la tiroglobulina, pero con persistencia de la captación mediastínica alta de I131, hizo plantear una causa espuria de esa captación, siendo la primera de ellas la persistencia del timo. Las imágenes del TAC confirman esa hipótesis diagnóstica (Figura 3).
El cáncer de nuestra paciente debe ser catalogado como agresivo dado que cumplía con varios criterios al respecto, como la multifocalidad, invasión extratiroidea, y permeación vascular. Además, aunque controversial en cuanto a pronóstico, existían metástasis ganglionares. En función de estos elementos pronósticos recibió inicialmente post cirugía 200 mCi de I131.
Después de la dosis terapéutica de I131, el seguimiento del cáncer papilar de tiroides consiste en la medición periódica de Tg, Ac anti Tg, ecografía cervical y eventualmente rastreo sistémico con I131, en un régimen de control anual. La frecuencia del seguimiento y la indicación de rastreo con I131 dependerá del grado de etapificación del paciente al momento del diagnóstico (alto, moderado o bajo riesgo de recurrencia), la calidad biológica del tumor y de los resultados de los controles precedentes.
Nuestro caso ejemplifica una situación de captación positiva del yodo radioactivo, falsa en cuanto a significar enfermedad tumoral, y que se explica por persistencia de timo.
La captación de yodo no es exclusiva de las células tiroideas, ya que otros tejidos también pueden hacerlo, como es el caso de las glándulas salivales, mucosa gástrica y nasofaríngea, y mama1,3. También puede evidenciarse captación difusa del isotópo por el hígado, debido al metabolismo de la tiroxina en ese órgano. El timo es otro tejido capaz de captar yodo, proyectando su imagen en la región cervical baja o mediastínica alta; esta localización crea la necesidad de diferenciarlo respecto de tejido remanente de un componente intratorácico del tiroides o de metástasis ganglionares cervicales muy bajas, de línea media o mediastínicas. Otras causas raras ajenas a la presencia de tejido tiroideo metastásico y que pueden explicar la captación de yodo radioactivo en el tórax, son el cáncer pulmonar primario o enfermedades inflamatorias pulmonares como tuberculosis y bronquiectasias (Tabla 1).
Tabla 1. Causas de captación de I131 a nivel cervical y torácico
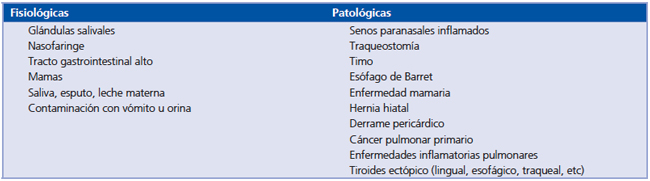
La captación torácica del isótopo puede ser difusa como en el caso de las metástasis pulmonares o focalizadas en el área mediastínica superior como en el caso de la persistencia del timo, o ganglios metastásicos, entre otros.
En la sumatoria de 4 trabajos, con un total de 342 pacientes adultos tratados por cáncer diferenciado de tiroides con captación de I131 en mediastino, un 8,2% presentó captación debido a timo persistente2. En otro estudio de 489 pacientes adultos tratados por cáncer diferenciado de tiroides se demostró captación mediastínica positiva de I131 en el 9,8% del total2; del grupo que tenía captación sólo circunscrita a mediastino, la mayoría correspondió a timo persistente (7 de 16 pacientes)2. En nuestra experiencia, en un estudio que comprendió 362 rastreos sistémicos con I131, de los cuales 96,4% correspondían a pacientes adultos, se evidenció que el 4,4% de esas exploraciones sistémicas correspondían a timo persistente4.
En el seguimiento de pacientes operados de cáncer diferenciado de tiroides, que además presentan hiperplasia tímica, se han detectado concentraciones de Tg levemente aumentadas, concomitantemente con la captación positiva de I131 en el mediastino, hallazgos que curiosamente revierten por la sola extirpación del remanente tímico, sin evidencias de recidiva tumoral2, implicando una poten– cialidad secretora de tiroglobulina, lo que podría explicarse por la expresión de mRNA Tg en las células tímicas, hecho que ha sido descrito en ratas5.
El timo es un órgano linfoepitelial que se encuentra en el mediastino superior, sobre el pericardio. Es de forma bilobulada, y aparece tempranamente en el desarrollo embrionario como una yema epitelial a partir de la tercera bolsa faríngea. Constituye un verdadero conglomerado de células epiteliales, ricas en linfocitos T en desarrollo (timocitos). El timo está organizado en una región cortical o externa y otra medular o interna, colonizadas por un gran número de células provenientes de la médula ósea, las cuales están distribuidas de manera diferencial: la corteza posee la mayoría de los timocitos (85-90%), que corresponden a linfocitos T inmaduros, escasos macrófagos y células epiteliales capaces de secretar hormonas y citoquinas. Los timocitos más maduros, juntos con las células dendríticas y la mayoría de los macrófagos se ubican en la médula. Sólo 5 a 10% de los linfocitos maduran y sobreviven para abandonar el timo; el resto sufre apoptosis in situ. Durante la vida fetal y después del nacimiento el tamaño del timo aumenta hasta alcanzar un máximo en la pubertad, para luego decrecer y atrofiarse con la edad (peso promedio de 22 g al momento del nacimiento y de 6 g en adultos). El timo es esencial para el desarrollo de los linfocitos T en la etapa fetal e infantil. En esas edades su ausencia da lugar a inmunodeficiencia de las células T. En población mayor de 20 años la persistencia de timo pesquisada con TAC de tórax alcanza a 17%2.
La presente comunicación comenta la dificultad que se puede generar en el seguimiento de pacientes adultos con cáncer diferenciado de tiroides por la interferencia que el timo persistente puede significar. Esta situación es un hecho de mayor presentación en niños, pero también debe estar presente en el análisis de pacientes adultos. En resumen, la conjunción de ausencia de hallazgos ecográficos cervicales, sin tiroglobulina positiva o con título bajos de ella implica que si se detecta captación de I131 a nivel mediastínico debe completarse el estudio con examen de TAC de tórax buscando como primera posibilidad tejido tímico persistente y luego otra explicación extratiroidea menos frecuente.
Referencias
- Shapiro B, Rufini V, Jarwan A, Geatti O, Kearfott K, Fig L, et al. 2006. False-Positive Radioiodine Scans in Thyroid Cancer. En: Wartofsky L. and Van Nostrand D. ed. Thyroid Cancer: A Comprehensive Guide to Clinical Management, 2 edición, Humana Press Inc 179-197.
- Haveman J, Phan H, Links T, Jager P, Plukker J. 2004. Implications of Mediastinal Uptake of 131I with Regard to Surgery in Patients with Differentiated Thyroid Carcinoma. Cancer 103 (1): 59-67.
- Shapiro B, Rufini V, Jarwan A, Geatti O, Kearfott K, Fig L, Kirkwood I, Gross M. 2000. Artifacts, anatomical and physiological variants, and unrelated disease that might cause false-positive whole-body 131-I scans in patients with thyroid cancer. Semin Nucl Med 30 (2): 115-132.
- Orellana P, Alfaro L, Quintana JC, Cattani A, Vargas J, Arteaga E. 2007. Captación tímica post dosis terapéutica del I131 en pacientes con cáncer diferenciado de tiroides. Abstracts II Congreso Chileno de Medicina Nuclear. Alasbimn Journal 9 (35).
- Li H, Carayanniotis G. 2005. Detection of thyroglobulin mRNA as truncated isoform(s) in mouse thymus. Inmunology 115: 85-89.
- Wilson LM, Barrington SF, Morrison ID, Kettle AG, Dojerty MJ, Coakley AJ. 1998. Therapeutic implications of thymic uptake of radioiodine in thyroid carcinoma. Eur J Nucl Med 25: 622-628.
- Davidson J, McDougall R. 2000. How frequently is the thymus seen on whole-body iodine131 diagnostic and post-treatment scans? Eur J Nucl Med 27: 425-430.
- Meller J, Becker W. 2000. The human sodium-iodine symporter (NIS) as a key for specific thymic iodine-131 uptake. Eur J Nucl Med 27: 473-474.