Distribución de polimorfismos del gen del antígeno-4 del linfocito T citotóxico en población chilena con diabetes mellitus tipo 1
Carolina Pizarro A.1, Karla Vásquez O.1, Francisca Salas P.1, Tamara Loeff W.1 y Francisco Pérez B1
Distribution of cytotoxic T lymphocyte antigen-4 gene polymorphisms in Chilean population with type 1 diabetes mellitus
1Laboratorio de Genómica Nutricional. Departamento de Nutrición. Facultad de Medicina. Universidad de Chile.
Correspondencia a:
Dr. Francisco Pérez Bravo
Laboratorio de Genómica Nutricional, Departamento de Nutrición, Facultad de Medicina, Universidad de Chile.
Independencia 1027 (3º piso), Santiago, Chile.
Teléfono: 56-2-2978 61 35.
E-mail: fperez@med.uchile.cl
Recibido: 07-01-2015
Aceptado: 03-03-2015
Background: Cytotoxic T lymphocyte antigen-4 (CTLA-4) molecule is an important regulator of T
cell activation involved in the down-regulation of immune response. Their polymorphisms +49 A/G
and CT60 have been suggested to confer susceptibility to autoimmune endocrine disorders. The aim
of this study was to determine the association of CTLA-4 gene polymorphisms with T1D in the Chilean
population. We also wanted to study if the combined haplotypes of +49 A/G and CT60 had an impact
on risk for T1D. Methods: To evaluate the impact of allelic variants CT60 and +49 A/G SNPs were studied in a Chilean population, including 248 T1D patients and 160 controls. Genotypes of both
polymorphisms of CTLA-4 gene were determinate by PCR-restriction fragment polymorphism (PCRRFLP).Results: No statistical differences were observed when comparing patients with diabetes and
controls for both CTLA-4 genotypes. However, the haplotype analysis between CT60 and +49 A/G
showed an interesting combination of risk conformed by G*G combination with an OR of 1.648 [1.19-
2.28], (p = 0.002). Conclusions: The G*G haplotype could be a risk marker in patients with T1D in
Chilean population.
Key words: Type 1 diabetes; CTLA-4 polymorphism; haplotypes; autoimmunity.
La diabetes mellitus tipo 1 (DM1) es una enfermedad de predisposición hereditaria que afecta principalmente a niños y adolescentes. Esta enfermedad se caracteriza por la destrucción progresiva de las células β pancreáticas, por células T. Lo que conduce a una disminución gradual en la producción de insulina1-3. La destrucción de islotes está mediada por una compleja interacción entre los linfocitos activados, macrófagos y citoquinas3-5. La diabetes mellitus ha alcanzado proporciones epidémicas y afecta a más de 150 millones de personas en el mundo, de los cuales la DM1 afecta a cerca del 10% de éstos. Por lo cual la búsqueda de genes candidatos es un tema de importancia6.
El antígeno-4 de los linfocitos T citotóxicos (CTLA- 4) es una molécula co-estimuladora expresada en linfocitos T activados y es un importante regulador negativo de la activación de células T. El gen CTLA-4 es considerado uno de los genes candidatos más importantes para la autoinmunidad y se ha informado de que se asocia con varios trastornos endocrinos, tales como DM1, enfermedad de Graves e hipotiroidismo autoinmune7.
El gen CTLA-4 se encuentra en el cromosoma 2 (2q33). Los polimorfismos en el gen CTLA-4 se han asociado previamente a DM1 en varias poblaciones8-10. Dos de los polimorfismo de un solo nucleótido (SNP) en el gen CTLA-4, +49 A/G (rs 231775) y CT60 (rs 3087243), han sido implicados en una serie de enfermedades autoinmunes, incluyendo la cirrosis biliar primaria, lupus eritematoso sistémico, artropatías inflamatorias crónicas y enfermedad celíaca11-14.
El SNP +49 A/G se encuentra en la región de codificación del péptido señal de CTLA-4 y se caracteriza por una sustitución de treonina (alelo A) a alanina (alelo G). La cual se ha demostrado tener un impacto en la expresión de CTLA-4 en la superficie celular15-16. Es propuesto que el alelo G contribuye al riesgo autoinmune al reducir la cantidad de CTLA-4 en la superficie de las células. Resultando en un aumento de la proliferación de células T en respuesta a la activación inmune.
El SNP CT60 de CTLA-4 se encuentra en la región 3’ no traducida del gen y el ligeramente menos común alelo A, se sugiere ser un protector de autoinmunidad7. Por el contrario, se cree que el alelo G imparte riesgo autoinmune por interferir con los procesos de corte y empalme. Resultando en la reducción de la producción de una forma soluble de CTLA-47, la cual se ha demostrado que inhibe la activación de células T in vitro17.
En un esfuerzo por contribuir a este tema, en este estudio nos propusimos como objetivo medir y comparar las frecuencias alélicas y genotípicas de los polimorfismos de CTLA-4 en pacientes diabéticos chilenos y sus controles.
Materiales y Métodos
Diseño y grupos de estudio
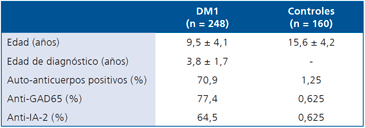
Este fue un estudio de casos y controles en 248 pacientes DM1 de Santiago, Chile. Los casos se diagnostican utilizando métodos estandarizados (WHO DiaMond Project) entre 2008 y 2012. El grupo control incluyó 160 voluntarios que no tienen diabetes o antecedentes de enfermedades autoinmunes. La Tabla 1 resume las historias clínicas y los marcadores autoinmunes en ambos grupos. El protocolo fue aprobado por la Junta de Revisión Institucional de la Facultad de Medicina de la Universidad de Chile. Los candidatos recibieron información completa sobre el estudio y los que aceptaron firmaron un consentimiento informado. En el caso de los niños menores de 12 años de edad el consentimiento fue firmado por sus padres o tutores legales.
Tabla 1. Características clínicas y marcadores inmunológicos en 248 niños con diabetes tipo 1 y 160 controles chilenos
Extracción de ADN
Una muestra de cada paciente y control fue obtenida a partir de 3 ml de sangre periférica. El suero sobrenadante y residuos sólidos se separaron por centrifugación. Un total de 500 μl de sangre se utilizaron para la obtención de ADN genómico, utilizando el protocolo estándar Solución Chomczynski (Winkler. Santiago, Chile). El ADN se cuantificó y su pureza se determinó en el equipo GeneQuant (Pharmacia Biotech. Cambridge, Inglaterra).
Determinación de autoanticuerpos
La detección de autoanticuerpos serológicos anti- GAD65 y anti-IA2 fue realizada en duplicado mediante el ensayo de inmunoabsorción ligado a enzimas (ELISA) de MediZym diagnóstico (Berlín, Alemania). El MediZym anti-GAD y anti-IA-2 fueron calibrados contra la preparación de referencia NIBSC 97/550 de la Organización Mundial de la Salud (OMS). Ambas determinaciones fueron métodos semi-cuantitativos, utilizando un punto de corte de 10 UI/ml. El ensayo anti-GAD muestra una sensibilidad del 91,7% y una especificidad del 98,0%. Por otro lado, el ensayo anti-IA-2 tiene una sensibilidad de 81,4% y una especificidad del 97,3%. Los valores están en el rango medio observado para esta técnica (ELISA) en el programa de estandarización de anticuerpos de la Diabetes (DASP).
Genotipado de los polimorfismos en CTLA-4
Los genotipos para el gen CTLA-4 se obtuvieron mediante amplificación por PCR convencional de ADN por análisis de fragmentos de restricción (RFLP). Para el polimorfismo +49 A/G se amplificó una región de 162 bp situada en el exón 1 del gen CTLA-4 con los cebadores: Forward 5’ GCTCTACTTCCTGAAGACCT-3’ y Reverse 5’AGTCTCACTCACCTTTGCAG-3’. La PCR se realizó en 20 μl de reacción con 5 pmol de cada cebador, 50 ng de ADN genómico, 200 μM de cada dNTP y 0,5 U de Taq polimerasa. Las temperaturas de reacción fueron: 95°C durante 7 min para la activación de la enzima, 40 ciclos de 95°C durante 30 s para la desnaturalización del ADN, 56°C durante 30 s para la unión de cebadores y 72°C durante 30 s para la extensión y finalmente 72°C durante 15 min para la extensión final.
Para el polimorfismo CT60 fue amplificada una sección de la región 3’UTR con los cebadores: Forward 5’ CACCACTATTTGGGATATACC-3’ y Reverse 5’ AGG TCTATATTTCAGGAAGGC-3’. La reacción de PCR se realizó en 25 μL de reacción con 5 pmol de cada cebador, 200 ng de ADN genómico, 200 μM de cada dNTP y 0,5 U de Taq polimerasa. Las temperaturas de reacción fueron enzima, 35 ciclos a 94°C durante 45 s para la desnaturalización del ADN, 52°C durante 50 s para la unión de cebadores y 72°C durante 1 min para la extensión y finalmente 72°C durante 10 min para la extensión final.
Los productos de PCR de 162 pb (+49 A/G) y 216 pb (CT60) se visualizaron en gel de agarosa al 1,5% con Bromuro de Etidio.
Para llevar a cabo el análisis de restricción, se utilizó 5 μl de producto de PCR con 0,5 U de enzima BvbI para +49 A/G y NcoI para CT60. La digestión se llevó a cabo a 37°C durante la noche y los productos se visualizaron en gel de agarosa al 3%. Las bandas que se obtuvieron para +49 A/G fueron de 162 pb, 90 pb y 74 pb, y para CT60 de 216 pb y 196 pb.
Análisis estadístico
El análisis de datos incluye la descripción de frecuencia de polimorfismos del gen CTLA-4 (+49 A/G y CT60). La prueba χ2 fue utilizada para comparar la independencia de las proporciones y determinar la asociación de genotipo y frecuencias de alelos entre casos y controles. La medición de riesgo de polimorfismos del gen CTLA-4 se realizó mediante el cálculo del cociente de riesgo (“odds ratio”). Los valores se consideraron significativos cuando p < 0,05. Los datos fueron analizados con el paquete estadístico STATA versión 10.0 (software Stata Estadística 1984-2009. StataCorp LP. Texas. EE.UU.). Las comparaciones de haplotipos fueron analizados por medio de pruebas de χ2 y la prueba exacta de Fisher usando el programa Shesis (URL: http://202.120.7.14/Analysis. php). Se evaluó la concordancia de frecuencias de genotipo en relación con la prueba exacta de Hardy-Weinberg mediante χ2.
Resultados
No se observaron diferencias estadísticamente significativas para la distribución genotípica y alélica cuando comparamos casos con DM1 frente a los sujetos controles. La Tabla 2 muestra la distribución del polimorfismo +49 A/G en ambos grupos de análisis. No se observaron diferencias significativas al comparar los pacientes con DM1 y los controles. Por otro lado, la población de pacientes y controles poseen una buena distribución, según el valor de Hardy-Weinberg obtenido (p = 0,60). En relación a la distribución del polimorfismo CT60, sólo pudimos encontrar una diferencia marginal en la distribución de alelo A, donde hay una mayor presencia de este alelo en los pacientes con DM1 (0,567) que en los controles (0,428). Para el polimorfismo CT60, las frecuencias haplotípicas de este SNP no mostraron diferencias significativas. Al corregir los valores mediante test de Bonferroni, estas diferencias estadísticas desaparecen.
Por último, la Tabla 3 resume la distribución de haplotipos compuestos entre los polimorfismos +49 A/G y CT60. Los resultados muestran que el haplotipo G*G tiene una mayor frecuencia en la población con DM1 en comparación con los controles, generando un OR = 1,648 (1,19-2,28). Los haplotipos combinados A*A y G*A mostraron valores OR inferiores 0,665 [0,50-0,88] y 0,595 [0,36-0,99] respectivamente, con las frecuencias más altas en los controles en comparación con los pacientes. Nuestros datos indican que la presencia del alelo G en el polimorfismo CT60 también aumenta el riesgo de desarrollar la enfermedad (OR = 1,648, p = 0,002).
Tabla 2. Distribución de frecuencias genotípicas y alélicas en ambos grupos de polimorfismos +49 A/G y CT60
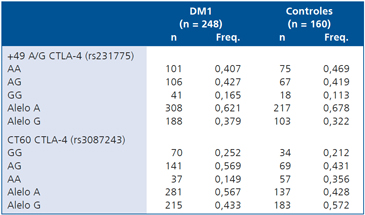
Tabla 3. Distribución de los haplotipos para los polimorfismos combinados +49 A/G y CT60 en pacientes DT1 y controles chilenos

Equilibrio de H-W p = 0,60 (rs231775); Equilibrio de H-W p = 0,13 (rs3087243).
Discusión
El análisis de los resultados muestra una buena distribución de los dos polimorfismos de CTLA-4 en nuestra población tanto en los casos como en controles, manteniendo el equilibrio de Hardy-Weinberg para los polimorfismos +49 A/G y CT60 (p = 0,60 y p = 0,13 respectivamente).
La distribución alélica y genotípica del polimorfismo + 49 A/G no mostró diferencias significativas en la población estudiada. Este polimorfismo se ha reportado con un alto valor de asociación en varias enfermedades autoinmunes en otras poblaciones, tales como pacientes con esclerosis múltiple, enfermedad de Graves, tiroiditis de Hashimoto, así como DM1 en población japonesa18-21. A pesar del resultado en este grupo de análisis, un estudio previo de nuestro grupo informó una asociación positiva entre el alelo G y DM1 en población chilena22. En contraste con nuestro estudio anterior, el polimorfismo +49 A/G de CTLA-4 no fue significativamente diferente entre los pacientes y los controles, y la frecuencia del alelo G fue menor. Además, no se observó ninguna distribución especial de los autoanticuerpos positivos para el genotipo GG. La única diferencia entre los dos estudios de nuestro grupo es la edad de los pacientes con diabetes, ya que los pacientes de este estudio fueron reclutados en un período más cerca del debut.
Esto es consistente con estudios en pacientes con DM1 en Alemania23, Japón24 y Estonia25, en el que ambos genotipos y portadores del alelo G tienen una fuerte asociación con la enfermedad. También se ha reportado que este mismo alelo posee una asociación entre los pacientes Suizos con DM1 y la enfermedad tiroídea autoinmune26. El alelo G también ha tenido una alta asociación positiva en pacientes alemanes con enfermedad celíaca14.
La distribución de los haplotipos mostró una magnitud interesante para el haplotipo G*G. Esto es de interés ya que demuestra, hasta ahora, una de las mayores asociaciones de estas dos variantes del gen CTLA-4 en población chilena. Debido a que la DM1 es una enfermedad multifactorial, estos resultados están ayudando en la búsqueda de marcadores de enfermedades autoinmunes y este haplotipo puede ser un posible marcador de riesgo de la enfermedad en pacientes chilenos.
Agradecimientos
Este trabajo fue financiado por FONDECYT 1100075 (Prof. Francisco Pérez-Bravo). Damos las gracias a todos los niños y las familias que participaron en esta investigación y el apoyo logístico dado por el Hospital San Borja Arriarán.
Referencias bibliográficas
- Alizadeh BZ, Koeleman BP. 2008. Genetic polymorphisms in susceptibility to Type 1 Diabetes. Clin Chim Acta 387: 9-17.
- Anderson MS, Bluestone JA. 2005. The NOD mouse: a model of immune dysregulation. Annu Rev Immunol 23: 447-485.
- Pirot P, Cardozo AK, Eizirik DL. 2008. Mediators and mechanisms of pancreatic eta-cell death in type 1 diabetes. Arq Bras Endocrinol Metabol 52: 156-165.
- Greersen PK, Behrens TW. 2006. Genetics of autoimmune diseases-disorders of immune homeostasis. Nat Rev Genet 7: 917-928.
- Atkinson MA, Bluestone JA, Eisenbarth GS, et al. 2011. How does type 1 diabetes develop?: the notion of homicide or beta-cell suicide revisited. Diabetes 60: 1370-1379.
- Wild S, Roglic G, Green A, Sicree R, King H. 2004. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 27 (5): 1047-1053.
- Ueda H, Howson JM, Espósito L, et al. 2003. Association of the T-cell regulatory gene CTLA4 with susceptibility to autoinmune disease. Nature 423: 506-511.
- Einarsdottir E, Soderstrom I, Lofgren-Burstrom A, et al. 2003. The CTLA4 region as a general autoimmune factor: an extended pedigree provides evidence for synergy wirth the HLA locus in the etiology of type I diabetes mellitus. Hashimoto´s thyroiditis and Graves´disease. Eur J Hum Genet II: 81-84.
- Nistico L, Buzzetti R, Pritchard LE, et al. 1996. The CTLA-4 gene region of chromosome 2q33 is linked to, and associated with, type I diabetes. Belgian Siabetes Registry. Hum Mol Genet 5: 1075-1080.
- Turpeinen H, Laine AP, Hermann R, et al. 2003. A linkage analysis of the CTLA4 gene region in Finnish patients with type I diabetes. Eur J Immunogenet 30: 289-293.
- Agarwal K, Jones DE, Daly AK, et al. 2000. CTLA-4 gene polymorphism confers susceptibility to primary biliary cirrhosis. J Hepatol 32: 538-541.
- Lee YH, Harley JB, Nath SK. 2005. CTLA-4 polymorphisms and systemic lupus erythematosus (SLE): a meta-analysis. Hum Genet 116: 361-367.
- Suppiah V, O’Doherty C, Heggarty S, et al. 2006. The CTLA4+49A/G and CT60 polymorphisms and chronic inflammatory arthropathies in Northern Ireland. Exp Mol Pathol 80: 141-146.
- van Belzen MJ, Mulder CJ, Zhernakova A, et al. 2004. CTLA4 +49 A/G and CT60 polymorphisms in Dutch coeliac disease patients. Eur J Hum Genet 12: 782-785.
- Anjos S, Nguyen A, Ounissi-Benkalha H, et al. 2002. A common autoimmunity predisposing signal peptide variant of the cytotoxic T-lymphocyte antigen 4 results in inefficient glycosylation of the susceptibility allele. J Biol Chem 277: 46478-46486.
- Maurer M, Loserth S, Kolb-Maurer A, et al. 2002. A polymorphism in the human cytotoxic T-lymphocyte antigen 4 (CTLA4) gene (exon 1 +49) alters T-cell activation. Immunogenetics 54: 1-8.
- Oaks MK, Hallett KM, Penwell RT, et al. 2000. A native soluble form of CTLA-4. Cell Immunol 201: 144-153.
- Ligers A, Xu C, Saarinen S, Hillert J, Olerup O. 1999. The CTLA-4 gene is associated with multiple sclerosis. J Neuroimmunol 97 (1-2): 182-190.
- Suppiah V, Alloza I, Heggarty S, Goris A, Dubois B, Carton H, et al. 2005. The CTLA4 +49 A/G*G-CT60*G haplotype is associated with susceptibility to multiple sclerosis in Flanders. J Neuroimmunol 164 (1-2): 148-153.
- Kavvoura FK, Akamizu T, Awata T, Ban Y, Chistiakov DA, Frydecka I, et al. 2007. Cytotoxic T-lymphocyte associated antigen4 gene polymorphisms and autoimmune thyroid disease: a meta-analysis. J Clin Endocrinol Metab 92 (8): 3162-3170.
- Kawasaki E, Imagawa A, Makino H, Uga M, Abiru N, Hanafusa T, et al. 2008. Differences in the contribution of the CTLA4 gene to susceptibility to fulminant and type 1A diabetes in Japanese patients. Diabetes Care 31 (8): 1608-1610.
- Balic I, Ángel B, Codner E, Carrasco E, Pérez-Bravo F. 2009. Association of CTLA-4 polymorphisms and clinical-immunologic characteristics at onset of type 1 diabetes mellitus in children. Hum Immunol 70 (2): 116-120.
- Zhernakova A, Eerligh P, Barrera P, Wesoly JZ, Huizinga TW, Roep BO, et al. 2005. CTLA4 is differentially associated with autoimmune diseases in the Dutch population. Hum Genet 118 (1): 58-66.
- Kawasaki E, Imagawa A, Makino H, Uga M, Abiru N, Hanafusa T, et al. 2008. Differences in the contribution of the CTLA4 gene to susceptibility to fulminant and type 1A diabetes in Japanese patients. Diabetes Care 31 (8): 1608-1610.
- Douroudis K, Prans E, Kisand K, Nemvalts V, Uibo R. 2009. Cytotoxic T-lymphocyte antigen 4 gene polymorphisms are associated with latent autoimmune diabetes in adults. Clin Chim Acta 403 (1-2): 226-228.
- Mayans S, Lackovic K, Nyholm C, Lindgren P, Ruikka K, Eliasson M, et al. 2007. Holmberg D. CT60 genotype does not affect CTLA-4 isoform expression despite association to T1D and AITD in northern Sweden. BMC Med Genet 8: 3.