Hemibalismo invalidante transitorio como debut de Diabetes Mellitus
Francisco Cordero A.1,2, Macarena Arias Th.1,2, Alejandra Lanas M.1 y Pedro Pineda B.1
Transient hemiballism as the presenting symptom of diabetes mellitus. Report of one case
1Sección de Endocrinologia Hospital Clínico Universidad de Chile.
2Residente Endocrinologia Universidad de Chile.
Correspondencia a: Dr. Francisco Cordero A. Departamento de Endocrinología Hospital Clínico Universidad de Chile.
Fono: (056)9788430. Fax: (056) 7776891 E-mail: dcoran@hotmail.com.
Recibido: 18 Junio de 2009
Aceptado: 20 Julio de 2009
Hemiballism is an uncommon neurological disorder characterized by uncontrollable movements of one lateral half of the body. We report a 56 years old male with a history of three weeks of polydipsia, polyuria and weight loss that, three days before consultation, started with hemiballism. A CAT scan without contrast showed a higher density in the lenticular nucleus and calcifications in caudate and lenticular nuclei. Diabetes was treated with regular insulin and hemiballism was controlled with neruoleptics. Ten days after admission a new CAT scan shows a partial regression of the lenticular lesion. After two months of follow up, the patient is asymptomatic.
Keywords: Hemichorea-hemiballism, Diabetes mellitus, Non-ketotic hyperglycaemia.
Paciente de 56 años, obrero de la construcción, con los antecedentes de hábito tabáquico, suspendido 6 años antes del ingreso, y uso ocasional de relajantes musculares.
Relata cuadro de tres meses de evolución caracterizado por poliuria, polidipsia y baja de peso de 15 kg con apetito conservado, a lo que se suman, tres días antes de la consulta, molestias inespecíficas en brazo izquierdo, con calambres, y luego movimientos involuntarios de esa extremidad, de intensidad progresiva, incontrolables, y que se manifiestan posteriormente también en la extremidad inferior ipsilateral con similares características.
Al examen neurológico el paciente se encontraba vigil, orientado, con lenguaje normal sin alteración de los pares craneanos. Destacaba la presencia de movimientos balísticos de la extremidad superior izquierda y movimientos coreicos en la extremidad inferior izquierda y la lengua, permanentes, pero que cedían durante el sueño. Se hospitaliza con los diagnósticos de Debut de Diabetes Mellitus y Hemibalismo izquierdo probablemente secundario a la hiperglicemia.
Entre los exámenes generales destacan los que se muestran en la Tabla 1.
El examen del fondo de ojo no mostró retinopatía diabética y la proteinuria de 24 horas fue negativa.
En la tomografía computada (TC) de cerebro, sin contraste, se observó mayor densidad a nivel del núcleo lenticular, especialmente del putamen, y de la porción posterior del núcleo caudado derecho. Se describen además, calcificaciones densas y heterogéneas en la cabeza del núcleo caudado y en la porción anterior del núcleo lenticular, que comprometen parcialmente el brazo anterior de la cápsula interna adyacente, sin efecto de masa significativo.
Al cumplir 10 días de evolución, con buen control metabólico, un nuevo TAC evidencia regresión parcial de la lesión lenticular descrita (Figura 1).
Tabla 1.
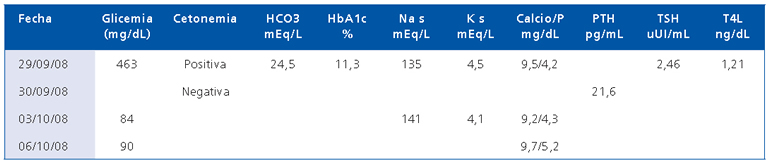
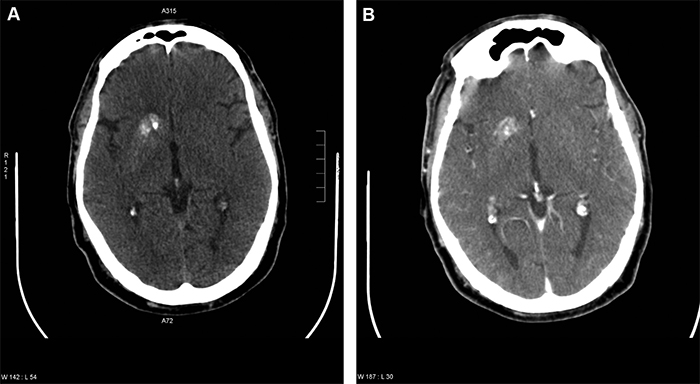
Figura 1. A) TC cerebral al ingreso. B) TC cerebral al cabo de 10 días de tratamiento.
Desde el punto de vista neurológico se trata con Haloperidol en infusión continua (hasta 7,5 mg/h) y contención física en razón de la intensidad de los movimientos hemibalísticos, que le causaron erosiones traumáticas en codos y rodillas.
La hiperglicemia requirió dosis bajas de insulina cristalina subcutánea. Los bajos requerimientos permitieron iniciar precozmente metformina, y suspender la insulina a los 14 días del ingreso.
A partir del 5º día el paciente requiere menos dosis de Haloperidol; es dado de alta a los 21 días con Haloperidol (5 mg/d) y Metformina (850 mg dos veces al día). Los movimientos involuntarios, aunque persistían, eran de menor intensidad, y desaparecieron completamente al mes después del alta.
Controlado dos meses después del inicio del cuadro mantiene muy buen control de su diabetes y no presenta hemibalismo.
Discusión
El hemibalismo es un trastorno motor infrecuente que se presenta como movimientos unilaterales anormales de las extremidades1. Ha sido caracterizado prácticamente como exponente patognomónico de una lesión en núcleo subtalámico de pronóstico grave. Sin embargo, revisiones más recientes muestran que el núcleo subtalámico está comprometido en la minoría de los casos y el pronóstico general es generalmente bueno, frecuentemente con remisión espontánea. Sin embargo, el pronóstico a largo plazo de la enfermedad cerebro vascular puede no ser tan favorable2.
En 1960, Bedwell3 comunicó un caso de hemibalismo en un paciente con hiperglicemia grave, que se resolvió cuando ésta fue corregida. La hiperglicemia como causa de hemibalismo ha sido comunicada sólo esporádicamente, hasta algunas publicaciones recientes en Asia, las cuales dan una mejor descripción de este trastorno4 con más de 60 casos comunicados; se considera como la segunda asociación causal más común, que tiende a presentarse en personas de mayor edad y es más frecuente en mujeres (65%). Un gran número de los casos corresponden a pacientes de origen asiático, lo cual sugiere una predisposición genética para este trastorno4.
Se cree que la combinación de una lesión reciente o antigua del núcleo estriado (que causa incremento del tono inhibitorio de los núcleos subtalámicos), y la hiperglicemia (que genera disminución de la inhibición GABAérgica del tálamo) podría ser responsable de la aparición de este movimiento hiperquinético unilateral5.
En el estado hiperglicémico, la demanda energética celular cambia hacia el metabolismo anaeróbico inhibiendo el ciclo de los ácidos tricarboxílicos y así el cerebro metaboliza el ácido gana amino butírico (GABA) como fuente energética alternativa. Pacientes con cetosis generan una fuente abundante de acetoacetato a partir del cual el GABA puede ser resintetizado; sin embargo, en los pacientes no cetósicos se produciría una rápida depleción de éste compuesto, generando la disminución de su actividad inhibitoria4.
La mayor predominancia en el sexo femenino podría deberse a la acción de los estrógenos, que disminuyen la función dopaminérgica del sistema nigroestriatal y aumentan la densidad de los receptores de dopamina. La baja concentración de estrógenos en la menopausia contribuiría al aumento de la sensibilidad en el receptor dopaminérgico estriatal4.
Una comunicación mostró que dos de cada tres pacientes presentaban calcificaciones en los ganglios basales y múltiples infartos corticales previos. En este contexto, el efecto metabólico agudo de la hiperglicemia produciría el trastorno de los movimientos5. También se puede presentar el trastorno motor en concomitancia con un infarto lacunar profundo de los ganglios basales, que pudiera no ser visible en la TC4.
Una revisión de series clínicas ha mostrado que las lesiones ubicadas fuera del núcleo subtalámico dan cuenta de más de la mitad de los casos comunicados de hemibalismo, siendo el núcleo estriado (caudado y putamen) el sitio más común, y asociándose con frecuencia a hiperglicemia6.
El análisis de una serie de 25 casos de hemibalismo7, identificó que las principales causas eran los accidentes vasculares, ya sea isquémicos o hemorrágicos (72%), lo cual concuerda con comunicaciones anteriores; el resto correspondía a causas más raras; entre ellas la hiperglicemia no cetósica sólo era responsable del 4% de los hemibalismos de esa serie.
Estudios más recientes han señalado causas no reconocidas, particularmente la hiperglicemia hiperosmolar no cetósica y a complicaciones de la infección por VIH, las que en conjunto explicarían una proporción importante de los casos de hemibalismo2.
La presentación típica asociada a este trastorno metabólico comienza con una hiperglicemia grave, no cetósica, secundaria a diabetes mellitus tipo 2. Una vez corregida la hiperglicemia los movimientos anormales desaparecen en horas, aunque en un 20% persiste con hemibalismo de menor intensidad por 3 meses. Hay casos atípicos con presentación tardía, posterior a la normalización de la glicemia, con recurrencias o persistencia del cuadro en el tiempo2.
Según el estudio de imágenes las lesiones habitualmente son unilaterales. La TC muestra atenuación de la densidad en el putamen opuesto al lado afectado, sin signos de efecto de masa, edema o pérdida de volumen. En la resonancia magnética, en T1 se encuentra una señal de alta intensidad en el putamen contralateral8.
Mientras variados sitios de los ganglios basales pueden mostrar una señal anormal, el putamen está siempre afectado. El diagnóstico diferencial de los hallazgos de la resonancia magnética debe considerar hemorragia subaguda, isquemia focal leve, encefalopatía hipóxica-isquémica, encefalopatía hepática crónica, intoxicación por manganeso e hipoglicemia grave.
Una característica importante de las imágenes alteradas es su regresión en el tiempo, aunque pueden persistir más allá de la mejoría clínica9.
En un estudio en que se usó PET-FDG se encontró que el metabolismo cerebral de la glucosa estaba marcadamente disminuido ipsilateralmente respecto del ganglio basal comprometido. Por otro lado, un estudio con SPECT para evaluar flujo, demostró que este estaba aumentado en el lado correspondiente al ganglio basal afectado10.
El tratamiento comprende terapia farmacológica con antidopaminérgicos, neurolépticos típicos y atípicos y agentes depletores de catecolaminas. Agentes neurolépticos típicos como el haloperidol y la flufenazina,que bloquean los receptores de dopamina, constituyen la primera línea terapéutica del hemibalismo.
Los neurolépticos atípicos como olanzapina, quetiapina y sulpiride inducen menos parkinsonismo y diskinesias tardías. La Clozapina puede ser útil en casos refractarios, pero puede causar agranulocitosis11.
En la series más numerosas, el haloperidol fue la mejor droga para suprimir los movimientos balísticos, seguido por la reserpina y el clonazepan. Se recomienda el uso por períodos cortos, ya que el cuadro en general es autolimitado; de este modo se reduce la exposición a los receptores D2 disminuyendo el riesgo de diskinesia tardía12.
Creemos que la presentación de este caso es relevante, pese a su baja frecuencia, por lo particular de la presentación clínica asociada a hiperglicemia y el complejo mecanismo fisiopatológico involucrado. Las publicaciones sobre el tema son escasas, lo que hace que el cuadro sea poco conocido y eventualmente no diagnosticado. Se sugiere por ello, la pesquisa de hiperglicemia en todo paciente que se encuentre cursando un cuadro de movimientos hemibalísticos y coreicos, ya que el manejo metabólico adecuado de la eventual hiperglicemia podría disminuir la morbilidad asociada, con regresión total del cuadro en la mayoría de los casos.
Referencias
- Chang CV, Felicio AC, Godeiro Cde O Jr, Matsubara LS, Duarte DR, Ferraz HB, et al. 2007. Chorea-ballism as a manifestation of decompensated type 2 diabetes mellitus. Am JMed Sci 2007; 333 (3): 175-177.
- Postuma RB, Lang AE. 2003. Hemiballism: revisiting a classic disorder. The Lancet Neurology 2 November http://neurology. thelancet.com
- Bedwell SF. 1960. Some observations on hemiballismus. Neurology 10: 619-622.
- Lin JJ, Chang MK. Hyperglycaemia.1994. Hemiballismhemichorea and non-ketotic J Neurol Neurosurg Psychiatry 57: 748-750 doi:10.1136/jnnp.57.6.748.
- Ifergane G, Masalha R, Herishanu YO. 2001. Transient hemichorea/hemiballismus associated with new onset hyperglycemia. Can J Neurol Sci 28: 365-368.
- Boughammoura-Bouatay A, Chebel S, Younes-Mhenni S, Frih- Ayed M. 2008. Biballism due to non-ketotic hyperglycaemia. Diabetes & Metabolism 34: 617-619.
- Vidakovic A, Dragasevic N, Kostic V. 1994. Hemiballism: report of 25 cases. Journal of Neurology, Neurosurgery, and Psychiatry 57: 945-949.
- Battisti C, Forte F, Rubenni E, Dotti MT, Bartali A, Gennari P, et al. 2009. Two cases of hemichorea-hemiballism with nonketotichyperglycemia: a new point of view. Neurol Sci Mar 21 30: 179-183.
- Kranick SM MD, Price RS MD, Prasad S MD, Hurtig HI MD. 2008. Clinical Reasoning: A 52-year-old woman with subacute hemichorea. Neurology 71: e59-e62.
- Jung Lung Hsu Han-Cheng Wang Wei-Chih Hsu. 2004. Hyperglycemia induced unilateral basal ganglion lesions with and without hemichorea a PET study. J Neurol 251: 1486-1490 doi 10.1007/s00415-004-0571-4.
- Handley A, Medcalf P, Hellier K, Dutta D. 2009. Movement disorders after stroke. Age and Ageing 38 (3): 260-266. 12. Poston KL, Frucht SJ. 2008. Movement disorder emergencies. J Neurol 255 (Suppl 4): 2-13.