Tumores hipofisiarios de presentación familiar
Carmen A. Carrasco M.1
Familial pituitary tumors
1Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia a: Carmen A. Carrasco M.
Departamento de Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile. Lira 85, 5° piso. Santiago de Chile
Fono: 2-3543095; Fax: 6385675 E-mail: cantonie@med.puc.cl
Recibido: 06 Agosto de 2009
Aceptado: 18 Agosto de 2009
Del total de los adenomas de la hipofisis, un 5% se presenta dentro de un contexto familiar. Los sindromes geneticos que presentan o incluyen a tumores pituitarios son: a) Neoplasia Endocrina Multiple tipo1 (NEM1, OMIM 131100); b) Complejo de Carney (CC, OMIM 160908) y c) Tumor pituitario familiar aislado o FIPA (gFamilial Isolated Pituitary Adenomah); un exponente que destaca en este tipo de tumores es el que produce acromegalia familiar aislada (OMIM 102200). Por ultimo, otra causa genetica asociada a tumor hipofisiario, aunque no hereditaria, es el Mc Cune-Albright (OMIM 174800), patologia que se incluye en esta revision.
En general, este grupo de tumores hipofisiarios asociados a sindromes geneticos, le generan al medico tratante dos tipos de desafios. Por una parte, al plantear el diagnostico de tumor hipofisiario, el problema se suscita como y cuando sospechar un eventual caracter familiar de ese adenoma, especialmente cuando es la primera manifestacion del sindrome, como ocurre en los FIPA y en algunas ocasiones en la NEM1, cuando el hiperparatirodismo primario no se ha expresado o diagnosticado. Para solucionar esta dificultad se deben buscar elementos de la historia clinica y caracteristicas del tumor que permitan plantear la conveniencia del estudio genetico. Por otra parte, y en el sentido inverso, ante un paciente con el diagnostico de un sindrome que predispone a la formacion de adenomas hipofisiarios, debe realizarse el tamizaje minimo necesario para descartar o afirmar en forma precoz la presencia del adenoma, mejorando asi su pronostico.
La presente revision tiene como objeto revisar los mecanismos moleculares envueltos en la aparicion de tumores hipofisiarios en los diferentes sindromes geneticos, asi como sus caracteristicas clinicas y particularidades, con el fin de facilitar al medico tratante la identificacion y manejo de esta patologia (Tabla 1).
Tabla 1. Síndromes genéticos asociados a adenomas hipofisiarios.
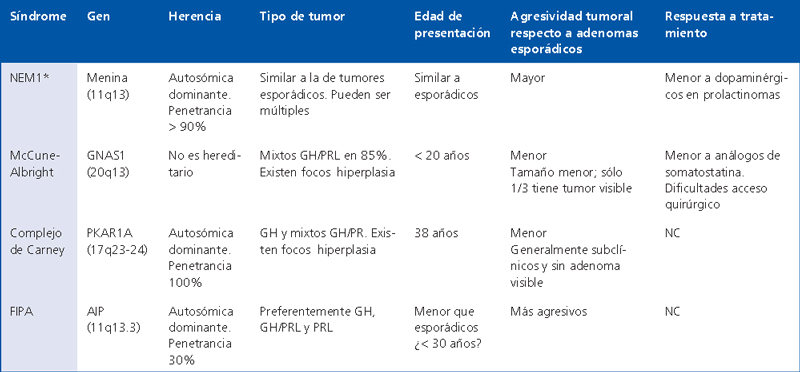
*Esta tabla no incluye MENx (CDKN1B, 12p13) ya que existen solo dos casos comunicados. No comunicado: NC.
Neoplasia endocrina multiple tipo 1
La neoplasia endocrina multiple tipo 1 es una condicion con herencia autosomica dominante que se caracteriza por la aparicion de tumores y disfunciones endocrinas a nivel paratiroideo, pancreatico y pituitario1. En el 70% de los casos indices es posible identificar mutaciones germinales heterocigotas inactivantes del gen MEN2. Este gen fue identificado en 1997 en el cromosoma 11q13 y es considerado como un gen supresor de tumores3. Codifica para la transcripcion de una proteina de localizacion predominantemente nuclear, la menina, la cual interactua con una serie de proteinas involucradas en la regulacion transcripcional, la estabilidad genomica, la division y la proliferacion celular. El mecanismo molecular mediante el cual la haploinsuficiencia de menina lleva a la formacion de tumores de hipofisis, seria que las mutaciones de MEN1 impedirian su interaccion con otras proteinas, alterando la regulacion del ciclo y la proliferacion celular4.
Se sabe que la menina reprime, mediante la interaccion proteina-proteina, la activacion transcripcional ejercida por JunD y por otros miembros de la familia NF-κB. Tambien, inhibe las vias de senalizacion de TGF-β (gtransforming growth factorh) y BMP-2 (gbone morphogenetic proteina- 2h) mediante su union a Samd3 y el complejo Smad1/54-8. Ademas, la menina que forma parte del complejo histonametiltransferasa, participa en la regulacion epigenetica de la expresion de genes como p27 y p189, que codifican para inhibidores de kinasas dependientes de ciclinas, los cuales controlan en forma negativa la progresión del ciclo celular. La participación de estos genes en la tumorogénesis pituitaria está avalada por modelos murinos KO para CDKN1-B (el cual codifica para p27), que muestran el desarrollo de hiperplasia multi orgánica y adenomas de hipófisis.
Por otra parte, la interacción con RPA2 y FANCD2 permite postular un rol activo de la menina en el control de la estabilidad genómica, ya que ambas proteínas son necesarias para la reparación, recombinación y replicación del ADN, avalando el rol de la menina en el control del ciclo celular10,11.
Estudios in vitro muestran que la depleción de menina en fibroblastos humanos induce su inmortalización12, mientras que la sobre expresión inhibe la proliferación de diferentes líneas celulares13, todo lo cual apoya su rol antiproliferativo y supresor de tumores. La presencia del fenotipo de NEM1, en ausencia de mutaciones de MEN1 que se denomina MENx o MEN4, sugiere la participación de otros genes en este síndrome. En el año 2002, el análisis genético de un modelo murino análogo de NEM1, pero de carácter autosómico recesivo, permitió identificar una mutación homocigota en el gen Cdkn1b, el cual codifica para el inhibidor de la ciclina dependiente de kinasa p2714. Más tarde, el 2006, se describe por primera vez la mutación de CDKN1B en un paciente con acromegalia e hiperparatirodismo primario, sin mutación en el gen MEN115, seguido de un segundo caso al año siguiente16. A pesar del entusiasmo inicial, la presencia de mutaciones en los genes de inhibidores dependientes de ciclinas en pacientes con MENx sigue siendo excepcional (< 1%)17. En relación a la participación de la menina en la patogenia de los adenomas esporádicos, sólo el 1% de estos presenta mutaciones inactivantes18,19.
¿Cuáles son las características diferenciales de estos tumores respecto a aquellos conocidos como formas esporádicas?
Se estima que entre el 40 y 50% de los pacientes con NEM1 presentarán en su evolución un adenoma hipofisiario1,20. A la inversa, en el 17% de los casos el adenoma de hipófisis es la primera manifestación del NEM120.
Si comparamos estos tumores a los esporádicos, tanto la edad de presentación como las características funcionales son similares, siendo más frecuente (85%) el prolactinoma. El modelo tumorogénico conocido como “two-hits” consiste en que a la mutación germinal de un gen supresor de tumores se agrega la pérdida del alelo normal a nivel somático. Este modelo se asocia a tumores que son más precoces y multicétricos, aunque con igual pronóstico que los esporádicos, como sucede con los adenomas paratiroídeos en el NEM1. Los tumores de hipófisis parecen ser la excepción, ya que los estudios coinciden en que la edad de presentación es similar a los esporádicos, que sólo en casos excepcionales son multicéntricos21, y en un estudio comparativo se señala que el pronóstico sería peor. Este estudio comparó 136 tumores pituitarios asociados a NEM1 con un grupo control pareado por sexo, edad al momento del diagnóstico y años de seguimiento20. Mostró que los tumores hipofisiarios asociados a NEM1 eran más invasores, con mayor frecuencia de macro adenomas y, en el caso de los tumores secretores, con mayor resistencia al tratamiento.
Frente a un adenoma aparentemente esporádico, la anamnesis debe indagar en forma dirigida sobre antecedentes de nefrolitiasis y tumores neuroendocrinos. La indicación de medir calcemia frente a todo tumor de hipófisis, con el objeto de diagnosticar un eventual hiperparatiroidismo primario que podría pasar desapercibido no ha sido evaluada en su relación costo beneficio, aunque a mi juicio parece atractivo y razonable. Sin embargo, dado el aumento con la edad de la prevalencia del hiperparatiroidismo esporádico, el rendimiento del test genético frente a los pacientes con adenoma de hipófisis e hiperparatirodismo primario dependerá de la edad del paciente, siendo menor a mayor edad.
En el caso de existir antecedentes familiares de tumores hipofisiarios, paratiroideos o neuroendocrinos pancreáticos, la recomendación es secuenciar MEN1 en búsqueda de posibles mutaciones.
Por otra parte, todo paciente portador de mutación en el gen MEN1 debe, a partir de los 5 años de edad, quedar programado para medir anualmente PRL, IGF-1 y cada tres años realizar resonancia magnética selar22. El diagnóstico precoz podría mejorar el pronóstico23, pero en la actualidad tanto el tratamiento como el seguimiento de los pacientes no difieren del indicado en los tumores esporádicos. El control de búsqueda debe mantenerse de por vida ya que los adenomas de hipófisis asociados a NEM1 pueden presentarse incluso sobre los 80 años de edad1,20.
Síndrome de McCune-Albright
El síndrome de McCune-Albright (MAS) es una enfermedad genética no hereditaria que se caracteriza por la presencia de displasia ósea fibrosa poliostótica, manchas cutáneas de color café con leche, alteraciones endocrinas como pubertad precoz, tirotoxicosis y tumores somatotropos. Su patogenia radica en la presencia de mosaicismos para mutaciones heterocigotas activantes del gen GNAS1, u oncogen gsp, el cual codifica para la subunidad estimulante alfa de la proteína G (cromosoma 20q13)24. Dicha mutación le confiere una actividad constitutiva independiente del complejo hormono-receptor con aumento de la señal mediada por el AMPc24,25. Las mutaciones descritas afectan el codón 201 del exón 8 de GNAS e implican la sustitución de arginina por histidina, cisteína, leucina o serina. La tasa de identificación de mutaciones en ADN periférico varía entre 36% y 71%; esta variabilidad se explica por la heterogeneidad clínica de los pacientes estudiados y las diferentes técnicas utilizadas para detectar la mutación26-28. Dado que tanto en el McCune-Albright como en el complejo de Carney, la vía de la PKA se mantiene persistentemente activada, se postula que en el caso de los somatotropos y somatolactotropos, la vía del AMPc ejercería una señal mitogénica con tendencia a la hiperplasia y a la formación de adenomas29,30.
En relación a la participación de GNAS1 en la patogenia de los adenomas esporádicos, el 40% de las acromegalias esporádicas presenta mutaciones somáticas de gsp31, siendo ellas excepcionales en otros tipos de adenomas.
¿Cuáles son las características diferenciales de estos tumores respecto a aquellos conocidos como formas esporádicas?
El 20% de los pacientes con McCune Albright presentan hipersecreción de GH en algún momento de su evolución32. El diagnóstico ocurre generalmente antes de los 20 años33 y las manifestaciones clínicas pueden pasar desapercibidas debido a las dismorfias craneofaciales secundarias a la displasia fibrosa poliostótica craneofacial y al cierre prematuro de los cartílagos de crecimiento inducido por la pubertad precoz que permite mantener una talla dentro del rango normal34.
En comparación a la acromegalia esporádica, la edad de diagnóstico es más temprana, con un promedio de 21 años (dispersión 4-40 años), y en más del 80% de los casos la secreción de GH se acompaña de la de prolactina35, lo cual ocurre sólo en el 30-40% de los adenomas esporádicos36. Una serie que buscaba caracterizar la acromegalia ligada al McCune-Albright encontró que sólo un tercio de los pacientes con secreción autónoma de GH presentaba tumor visible y que estos generalmente eran menores de 2,5 cm de diámetro32. Esto es concordante con los hallazgos histológicos que muestran que, al igual que en la acromegalia del Complejo de Carney, existen focos de hiperplasia mamosomatotrópica y no sólo adenoma37.
Las series de pacientes y los casos clínicos publicados parecen indicar que la evolución de la hipersecreción de GH es de lenta progresión, aunque no se dispone de seguimientos a largo plazo38,39. El exceso de hormona de crecimiento puede agravar el compromiso óseo; al respecto existe una comunicación que indica que 40% de los pacientes con displasia craneofacial y gigantismo/acromegalia presentan sordera o defectos visuales versus sólo un 4% en los individuos sin exceso de GH32.
En relación al tratamiento, si bien los tumores son de menor tamaño que los esporádicos, la cirugía se ve dificultada por la displasia ósea de la base del cráneo que muchas veces dificulta el abordaje quirúrgico, tanto por la vía transesfenoidal como transcraneana34,40. No contamos con estudios que evalúen específicamente los resultados quirúrgicos en estos pacientes, aunque una revisión reciente dice que la curación bioquímica es excepcional41. En relación al tratamiento médico, se describe una respuesta variable a los análogos de la somatostatina, pero una vez más contamos sólo con casos clínicos o series de número limitado40. El pegvisomant ha demostrado ser eficaz en pacientes resistentes a los análogos de somatostatina, pero no existen seguimientos a largo plazo que avalen su seguridad respecto al crecimiento del tumor o la evolución de la displasia ósea sometida a grandes concentraciones de GH. Finalmente, la radioterapia se reserva como alternativa de excepción dado el riesgo potencial de degeneración sarcomatosa42.
Dado que la acromegalia no es, en general, la primera manifestación del síndrome, el diagnóstico se plantea durante el seguimiento de pacientes afectados por el McCune- Albright. Dado que el exceso de GH puede pasar clínicamente desapercibido por la dismorfia craneofacial, los pacientes deben periódicamente ser medidos en sus IGF-1 y prolactina para detectar el compromiso mamosomatotrópico. En el caso de sospechar el diagnóstico, deberá realizarse el test de supresión de glucosa para GH y la resonancia magnética selar34.
Complejo de Carney
El complejo de Carney (CC) es una condición de presentación excepcional, que se caracteriza clínicamente por la presencia de mixomas cutáneos y cardíacos, lentiginosis y lesiones dérmicas, adenomas hipofisiarios, hiperplasia micronodular pigmentada a nivel suprarrenal con Cushing ACTH independiente, tumores testiculares y ováricos y schwanomas melanocíticos entre otros30. En el 60% de los casos se pueden identificar mutaciones inactivantes del gen PRKAR1A, el cual codifica para la sub-unidad regulatoria 1a (R1a) de la proteína kinasa A43. Al igual que la menina, la PRKAR1A actúa como un gen supresor de tumores en los tejidos afectados, con pérdida de heterozigocidad de la región 17q22-24 a nivel del tejido tumoral44. La pérdida de la función de R1a se asocia a la activación permanente de la vía del AMPc, lo cual induce una señal proliferativa a nivel de múltiples órganos, especialmente endocrinos.
Los esfuerzos para aclarar los mecanismos fisiopatológicos que expliquen la proliferación somatotrópica frente mutaciones inactivantes de PKAR1A se enfrentan a la dificultad de crear modelos animales que reproduzcan el fenotipo. Los ratones KO para R1a si bien desarrollan algunos de los componentes propios del CC, no presentan tumores hipofisiarios. Solo recientemente, un equipo logró desarrollar un modelo de ratón “kock out” (KO) específico a nivel pituitario que desarrolló adenomas pituitarios y alteraciones del eje de GH45, lo cual reafirma el rol patogénico de las mutaciones de PKAR1A en el CC. En cuanto al mecanismo, los estudios de expresión muestran que tanto la ausencia como las alteraciones en la función de la R1a se acompañan de aumento de la actividad PKA a nivel de las células afectadas46. Si bien la mayoría de las mutaciones que afectan a PRKAR1A tiene como consecuencia la generación de un “stop” codón prematuro y ausencia de proteína, existe un pequeño grupo que logra escapar al deterioro de RNA y genera proteínas truncas. Estudios in vitro utilizando construcciones con estas mutaciones muestran que la proteína sufre cambios de su conformación que impiden la unión entre la sub-unidad R1a y las sub unidades catalíticas, con aumento de la actividad PKA como resultante47.
En relación al rol de PKAR1A en los adenomas esporádicos, este es limitado ya que no se han descrito hasta la fecha mutaciones somáticas de R1a48,49.
¿Cuáles son las características diferenciales de estos tumores respecto a aquellos conocidos como formas esporádicas?
Los adenomas hipofisiarios surgidos en el contexto de un CC son exclusivamente de estirpe somatotrópica o mamosomatotrópica, con un promedio en su edad de presentación de 35,8 años37. La progresión del tumor es lenta y sólo excepcionalmente son de conducta agresiva. Si bien cerca del 79% de los pacientes con CC presentan alteraciones bioquímicas con aumento de IGF-1 y prolactina, sólo una minoría de ellos desarrolla el cuadro clínico de acromegalia y un adenoma hipofisiario visible a la RM29,50. Por otra parte, a diferencia de los adenomas esporádicos en los cuales el origen es monoclonal, en este caso se han identificado focos múltiples de hiperplasia mamosomatotrópica37.Esto explicaría la alta prevalencia de alteraciones bioquímicas en los pacientes, pero no aclara el porqué de la benignidad de la evolución tumoral.
La edad promedio al momento del diagnóstico del Complejo de Carney es 20 años; la mayoría de los pacientes presenta durante la infancia las manifestaciones cutáneas, mixomas cardíacos e hiperplasia suprarrenal nodular primaria pigmentada (PPNAD, “primary pigmented nodular adrenal disease”)50. Por lo tanto, es excepcional que una acromegalia aparentemente esporádica corresponda a un CC. Aún así, una adecuada anamnesis personal y familiar podría permitir diagnosticar este síndrome. Los mixomas cardiacos familiares, la lentiginosis y el PPNAD son altamente sugerentes y la concomitancia con un schwanoma melanocítico es prácticamente patognomónica.
Ahora bien, si nos enfrentamos a un paciente con el diagnóstico de CC, se recomienda realizar un seguimiento anual con IGF-1 y prolactina50.
El tratamiento de estos tumores es similar al de los somatotropos esporádicos, con resolución quirúrgica en el caso de tumores identificables en la RM y agonistas de la somatostatina en el caso de acromegalia clínica sin tumor visible. No se han comunicado estudios que comparen la sensibilidad de estos tumores al tratamiento médico respecto de aquellos que producen acromegalia esporádica.
Adenomas pituitarios familiares aislados
El término FIPA (Familial isolated pituitary adenomas) se refiere a la condición clínica en la cual una familia presenta a lo menos dos miembros afectados por tumores pituitarios, con estudio genético negativo para MEN1 y PRKAR1A. Este tipo de adenomas puede llegar a representar el 1% del universo de adenomas hipofisiarios de un centro de referencia; se clasifican en homogéneos, cuando todos los afectados tienen el mismo tipo de tumor (por ej. acromegalia) y heterogéneos, cuando existen distintos tipos de ellos51. El mayor estudio descriptivo de FIPA fue publicado por el equipo de Beckers en el 2006, mediante la recolección de datos procedentes de Bélgica, Italia, Francia y Países bajos, que incluyó a más de 90 familias52. El 75% de los afectados presentaba acromegalia y prolactinomas, con predominio de pacientes mujeres, lo cual podría explicar la alta prevalencia de prolactinomas. En comparación con los controles, los pacientes FIPA no presentaban diferencias en relación a tamaño o agresividad, pero eran 4 años más jóvenes al momento del diagnóstico. El 74,6% de los afectados eran familiares de primer grado, lo cual sugiere una herencia autosómica dominante.
El análisis del subgrupo con acromegalia familiar aislada, mostró, que la edad de presentación era 10 años menor que la de los controles y que los adenomas presentaban un mayor tamaño y agresividad.
Durante el mismo año en que este estudio clínico descriptivo fue publicado, el equipo de Vierimaa describió el análisis genético de dos familias con somatotropinomas, prolactinomas y tumores mixtos para GH y prolactina53. Mediante análisis de asociación (linkage), este grupo logró relacionar la región 11q12-11q13 con la presencia de adenomas, lo que finalmente llevó a la identificación del gen AIP (aryl hydrocarbon receptor interacting protein) como el principal candidato para la búsqueda de mutaciones. El estudio confirmó en los pacientes afectados la presencia de la mutación inactivante Q14X del gen AIP y su ausencia en 209 controles. La extensión del estudio a 73 familias FIPA mostró que el 15% presentaba mutaciones de AIP, y que este porcentaje se elevaba a 50% en las familias con acromegalia familiar aislada54.
El gen AIP se encuentra ubicado en la región 11q13, y codifica para una proteína de 330 amino ácidos que forma complejos con AHR (aryl hydrocarbon receptor) y con HSP90 (heat shock protein 90kDa)55. Las mutaciones descritas conducen en su mayoría a la generación de un “stop” codón prematuro y a la pérdida de la región carboxiterminal de la proteína, necesaria para su unión tanto a AHR como HSP9056,57. Por lo tanto, es esperable que aquellas proteínas truncas generadas por el alelo mutado hayan perdido su capacidad de unión a AHR, factor de transcripción que participa en la respuesta a la hipoxemia, diferenciación celular y regulación del ciclo celular58. AHR tiene ligandos exógenos como la dioxina59 y puede ser activado por la vía de la PKA. Esto permite su translocación al núcleo y la estimulación de la expresión de genes dependientes de AHR, diferentes de aquellos activados post unión a la dioxina60.
AIP es capaz de unirse y atenuar la función de PDE4A5, fosfodiesterasa hipofisiaria a cargo de inactivar la vía de la PKA mediante la hidrólisis del AMPc61. Este nexo entre AIP y la vía de la PKA es atractivo y se sabe que mutaciones de otra fosfodiesterasa, PDE114A, se asocian a formas esporádicas de hiperplasia micronodular pigmentada en las cuales el AMPc está elevado. Esto conecta con el conocimiento sobre el nexo entre vía del AMPc y la acromegalia del McCune-Albright y CC (Figura 1).
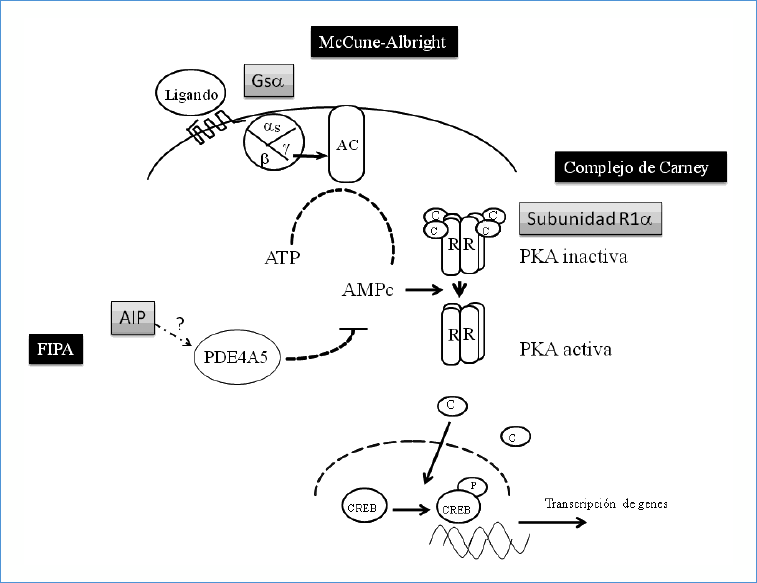
Figura 1. Vía del AMPc y tumorogénesis hipofisiaria: Tras la unión de la hormona a su receptor se produce la activación de la proteína G, que libera la subunidad Gsα la cual activa la adenilato ciclasa (AC). Como resultado se induce un aumento del AMPc, el cual activará la PKA, permitiendo que las subunidades reguladoras (R) liberen las subunidades catalíticas (C), las cuales irán a fosforilar CREB. Este compuesto se unirá al ADN en regiones promotoras de genes cibla, como la GH. PDE4A5 está a cargo de inactivar el AMPc, extinguiendo la señal. La presencia de gsp impide la inactivación de Gsα y la mutación de R1a impide su unión a las subunidades catalíticas que se mantienen activas. La consecuencia es un aumento del AMPc y de la señal mitogénica.
El hecho de que exista pérdida de heterozigocidad del alelo mutado en el tejido tumoral permite postular un rol de gen supresor de tumores53. Estudios in vitro apoyan el rol anti proliferativo de AIP ya que células GH3 (línea celular murina somatotrópica) transfectadas con vectores portadores de AIP mutado presentan una proliferación mayor a la de las células transfectadas con el gen “wild type”62. Estudios de inmunohistoquímica efectuados en adenomas de pacientes con mutaciones de AIP muestran, a su vez, una sensibilidad de 75% y una especificidad de 95% en la identificación de pacientes con mutaciones germinales, aunque hasta ahora se trata de sólo un estudio con un número limitado de casos63.
El rol de AIP en los adenomas esporádicos fue investigado en forma entusiasta tras el descubrimiento de su implicancia en los FIPA, pero se estima que sólo 3,2% de los adenomas esporádicos presentan mutaciones en AIP, siendo ellos pacientes jóvenes y principalmente acromegálicos62-65.
¿Cuáles son las características diferenciales de estos tumores respecto a aquellos conocidos como formas esporádicas?
Los pacientes con mutaciones AIP son más jóvenes que los pacientes portadores de adenomas esporádicos (aproximadamente 25 versus 38 años)62, tienen más gigantismo y tumores de mayor tamaño54. Actualmente, se postula que todo paciente con el antecedente de adenoma hipofisiario familiar que no se presente en el seno de una neoplasia endocrina múltiple tipo 1 ni CC debería ser sometido a la búsqueda de mutaciones de AIP. Es importante destacar que la penetrancia de la enfermedad es baja (30%), lo cual hace difícil el diagnóstico del carácter familiar del adenoma mediante la anamnesis53, lo que ha llevado a algunos grupos a postular la búsqueda de mutaciones de AIP en todo acromegálico menor de 30 años, aun en ausencia de antecedentes familiares64.
No contamos con estudios que comparen el pronóstico de los pacientes con mutaciones en AIP con el de los esporádicos ni tampoco la sensibilidad al tratamiento médico entre ambos grupos.
Conclusiones
Sólo 5% de los tumores hipofisiarios se presenta bajo una forma familiar, los costos de los test genéticos son altos y no están disponibles en Chile; por lo tanto, debemos seleccionar los pacientes que ameriten un estudio genético. La anamnesis personal y familiar es una herramienta indispensable. Aquellos pacientes que cumplan criterios de NEM1 podrán elegir si desean ser sometidos al test, una vez recibido consejo genético. En caso de tumores pituitarios familiares aislados, en especial la acromegalia familiar aislada, se puede ofrecer el test en búsqueda de mutaciones de AIP.
Por otra parte, los estudios realizados en los adenomas hipofisiarios familiares han permitido aumentar nuestros conocimientos sobre los mecanismos moleculares que pueden llevar a la formación de adenomas pituitarios. La vía del AMPc juega un rol fundamental en a lo menos el Mc Cune-Albright y CC, y queda por determinar el mecanismo patogénico en el caso de la NEM1 y mutación de AIP. Esperamos que el avance en el conocimiento de estos síndromes de escasa prevalencia permita a su vez avanzar en el esclarecimiento de la patogenia de los adenomas esporádicos con el fin de optimizar el manejo y pronóstico de los pacientes.
Referencias
- Referencias 1. Marx S, Spiegel AM, Skarulis MC, Doppman JL, Collins FS, Liotta LA. 1998. Multiple endocrine neoplasia type 1: clinical and genetic topics. Ann Intern Med 129: 484-494.
- Ozawa A, Agarwal SK, Mateo CM, Burns AL, Rice TS, Kennedy PA, et al. 2007. The parathyroid/pituitary variant of multiple endocrine neoplasia type 1 usually has causes other than p27Kip1 mutations. J Clin Endocrinol Metab 92: 1948-1951.
- Guru SC, Agarwal SK, Manickam P, Olufemi SE, Crabtree JS, Weisemann JM, et al. 1997. A transcript map for the 2.8-Mb region containing the multiple endocrine neoplasia type 1 locus. Genome Res 7: 725-735.
- Agarwal SK, Kennedy PA, Scacheri PC, Novotny EA, Hickman AB, Cerrato A, et al. 2005. Menin molecular interactions: insights into normal functions and tumorigenesis. Horm Metab Res 37: 369-374.
- Pfarr CM, Mechta F, Spyrou G, Lallemand D, Carillo S, Yaniv M. 1994. Mouse JunD negatively regulates fibroblast growth and antagonizes transformation by ras. Cell 76: 747-760.
- Heppner C, Bilimoria KY, Agarwal SK, Kester M, Whitty LJ, Guru SC, et al. 2001. The tumor suppressor protein menin interacts with NF-kappaB proteins and inhibits NF-kappaB-mediated transactivation. Oncogene 20: 4917-4925.
- Kaji H, Canaff L, Lebrun JJ, Goltzman D, Hendy GN. 2001. Inactivation of menin, a Smad3-interacting protein, blocks transforming growth factor type beta signaling. Proc Natl Acad Sci U S A 98: 3837-3842.
- Sowa H, Kaji H, Hendy GN, Canaff L, Komori T, Sugimoto T, et al. 2004. Menin is required for bone morphogenetic protein 2- and transforming growth factor beta-regulated osteoblastic differentiation through interaction with Smads and Runx2. J Biol Chem 279: 40267-40275.
- Bai F, Pei XH, Nishikawa T, Smith MD, Xiong Y. 2007. p18Ink4c, but not p27Kip1, collaborates with Men1 to suppress neuroendocrine organ tumors. Mol Cell Biol 27: 1495-1504.
- Sukhodolets KE, Hickman AB, Agarwal SK, Sukhodolets MV, Obungu VH, Novotny EA, et al. 2003. The 32-kilodalton subunit of replication protein A interacts with menin, the product of the MEN1 tumor suppressor gene. Mol Cell Biol 23: 493-509.
- Jin S, Mao H, Schnepp RW, Sykes SM, Silva AC, D’Andrea AD et al, 2003. Menin associates with FANCD2, a protein involved in repair of DNA damage. Cancer Res 63: 4204-4210.
- Lin SY, Elledge SJ. 2003. Multiple tumor suppressor pathways negatively regulate telomerase. Cell 113: 881-889.
- Kim YS, Burns AL, Goldsmith PK, Heppner C, Park SY, Chandrasekharappa SC, et al. 1999. Stable overexpression of MEN1 suppresses tumorigenicity of RAS. Oncogene 18: 5936- 5942.
- Fritz A, Walch A, Piotrowska K, Rosemann M, Schaffer E, Weber K, et al. 2002. Recessive transmission of a multiple endocrine neoplasia syndrome in the rat. Cancer Res 62: 3048-3051.
- Pellegata NS, Quintanilla-Martínez L, Siggelkow H, Samson E, Bink K, Hofler H, et al. 2006. Germ-line mutations in p27Kip1 cause a multiple endocrine neoplasia syndrome in rats and humans.
- Proc Natl Acad Sci U S A 103: 15558-15563. 16. Georgitsi M, Raitila A, Karhu A, van der Luijt RB, Aalfs CM, Sane T, Vierimaa O, et al. 2007. Germline CDKN1B/p27Kip1 mutation in multiple endocrine neoplasia. J Clin Endocrinol Metab 92: 3321-3325.
- Agarwal SK, Mateo CM, Marx SJ. 2009. Rare germline mutations in cyclin-dependent kinase inhibitor genes in multiple endocrine neoplasia type 1 and related states. J Clin Endocrinol Metab 94: 1826-1834.
- Levy A, Lightman S. 2003. Molecular defects in the pathogenesis of pituitary tumours. Front Neuroendocrinol 24: 94-127.
- Karhu A, Aaltonen LA. 2007 Susceptibility to pituitary neoplasia related to MEN-1, CDKN1B and AIP mutations: an update. Hum Mol Genet 16 Spec No 1: R73-79.
- Verges B, Boureille F, Goudet P, Murat A, Beckers A, Sassolas G, et al. 2002. Pituitary disease in MEN type 1 (MEN1): data from the France-Belgium MEN1 multicenter study. J Clin Endocrinol Metab 87: 457-465.
- Ratliff JK, Oldfield EH. 2000. Multiple pituitary adenomas in Cushing’s disease. J Neurosurg 93: 753-761.
- Brandi ML, Gagel RF, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, et al. 2001. Guidelines for diagnosis and therapy of MEN type 1 and type 2. J Clin Endocrinol Metab 86: 5658-5671.
- Marx SJ, Nieman LK. 2002. Aggressive pituitary tumors in MEN1: do they refute the two-hit model of tumorigenesis? J Clin Endocrinol Metab 87: 453-456.
- Weinstein LS, Shenker A, Gejman PV, Merino MJ, Friedman E, Spiegel AM. 1991. Activating mutations of the stimulatory G protein in the McCune-Albright syndrome. N Engl J Med 325: 1688-1695.
- Lania A, Persani L, Ballare E, Mantovani S, Losa M, Spada A. 1998. Constitutively active Gs alpha is associated with an increased phosphodiesterase activity in human growth hormonesecreting adenomas. J Clin Endocrinol Metab 83: 1624-1628.
- Lumbroso S, Paris F, Sultan C. 2004. Activating Gsalpha mutations: analysis of 113 patients with signs of McCune-Albright syndrome-a European Collaborative Study. J Clin Endocrinol Metab 89: 2107-2113.
- de Sanctis C, Lala R, Matarazzo P, Balsamo A, Bergamaschi R, Cappa M, et al. 1999. McCune-Albright syndrome: a longitudinal clinical study of 32 patients. J Pediatr Endocrinol Metab 12: 817- 826.
- Román R, Johnson MC, Codner E, Cattani A, García H, Mericq V, et al. 2001. [Clinical and molecular study of Chilean patients with McCune-Albright syndrome]. Rev Méd Chile 129: 1365-1372.
- Horvath A, Stratakis CA. 2008. Clinical and molecular genetics of acromegaly: MEN1, Carney complex, McCune-Albright syndrome, familial acromegaly and genetic defects in sporadic tumors. Rev Endocr Metab Disord 9: 1-11.
- Boikos SA, Stratakis CA. 2007. Molecular genetics of the cAMPdependent protein kinase pathway and of sporadic pituitary tumorigenesis. Hum Mol Genet 16 Spec No 1: R80-87.
- Vallar L, Spada A, Giannattasio G. 1987. Altered Gs and adenylate cyclase activity in human GH-secreting pituitary adenomas. Nature 330: 566-568.
- Akintoye SO, Chebli C, Booher S, Feuillan P, Kushner H, Leroith D, et al. 2002. Characterization of gsp-mediated growth hormone excess in the context of McCune-Albright syndrome. J Clin Endocrinol Metab 87: 5104-5112.
- Chanson P, Dib A, Visot A, Derome PJ. 1994. McCune-Albright syndrome and acromegaly: clinical studies and responses to treatment in five cases. Eur J Endocrinol 131: 229-234.
- Christoforidis A, Maniadaki I, Stanhope R. 2006. McCune- Albright syndrome: growth hormone and prolactin hypersecretion. J Pediatr Endocrinol Metab 19 Suppl 2: 623-625.
- Cuttler L, Jackson JA, Saeed uz-Zafar M, Levitsky LL, Mellinger RC, Frohman LA. 1989. Hypersecretion of growth hormone and prolactin in McCune-Albright syndrome. J Clin Endocrinol Metab 68: 1148-1154.
- de Pablo F, Eastman RC, Roth J, Gorden P. 1981. Plasma prolactin in acromegaly before and after treatment. J Clin Endocrinol Metab 53: 344-352.
- Boikos SA, Stratakis CA. 2006. Pituitary pathology in patients with Carney Complex: growth-hormone producing hyperplasia or tumors and their association with other abnormalities. Pituitary 9: 203-209.
- Lala R, Matarazzo P, Andreo M, Defilippi C, de Sanctis C. 2002. Impact of endocrine hyperfunction and phosphate wasting on bone in McCune-Albright syndrome. J Pediatr Endocrinol Metab 15 Suppl 3: 913-920.
- Premawardhana LD, Vora JP, Mills R, Scanlon MF. 1992. Acromegaly and its treatment in the McCune-Albright syndrome. Clin Endocrinol (Oxf) 36: 605-608.
- Galland F, Kamenicky P, Affres H, Reznik Y, Pontvert D, Le Bouc Y, et al. 2006. McCune-Albright syndrome and acromegaly: effects of hypothalamopituitary radiotherapy and/or pegvisomant in somatostatin analog-resistant patients. J Clin Endocrinol Metab 91: 4957-4961.
- Dou W, Lin N, Ma W, Yang Y, Zhu H, Sun J, et al. 2008. Transsphenoidal surgery in a patient with acromegaly and McCune-Albright syndrome: application of neuronavigation. J Neurosurg 108: 164-169.
- Mortensen A, Bojsen-Moller M, Rasmussen P. 1989. Fibrous dysplasia of the skull with acromegaly and sarcomatous transformation. Two cases with a review of the literature. J Neurooncol 7: 25-29.
- Kirschner LS, Carney JA, Pack SD, Taymans SE, Giatzakis C, Cho YS, et al. 2000. Mutations of the gene encoding the protein kinase A type I-alpha regulatory subunit in patients with the Carney complex. Nat Genet 26: 89-92.
- Bossis I, Voutetakis A, Matyakhina L, Pack S, Abu-Asab M, Bourdeau I, et al. 2004. A pleiomorphic GH pituitary adenoma from a Carney complex patient displays universal allelic loss at the protein kinase A regulatory subunit 1A (PRKARIA) locus. J Med Genet 41: 596-600.
- Yin Z, Williams-Simons L, Parlow AF, Asa S, Kirschner LS. 2008. Pituitary-specific knockout of the Carney complex gene Prkar1a leads to pituitary tumorigenesis. Mol Endocrinol 22: 380-387.
- Robinson-White A, Meoli E, Stergiopoulos S, Horvath A, Boikos S, Bossis I, et al. 2006. PRKAR1A Mutations and protein kinase A interactions with other signaling pathways in the adrenal cortex. J Clin Endocrinol Metab 91: 2380-2388.
- Greene EL, Horvath AD, Nesterova M, Giatzakis C, Bossis I, Stratakis CA. 2008. In vitro functional studies of naturally occurring pathogenic PRKAR1A mutations that are not subject to nonsense mRNA decay. Hum Mutat 29: 633-639.
- Sandrini F, Kirschner LS, Bei T, Farmakidis C, Yasufuku-Takano J, Takano K, et al. 2002. PRKAR1A, one of the Carney complex genes, and its locus (17q22-24) are rarely altered in pituitary tumours outside the Carney complex. J Med Genet 39: 78.
- Kaltsas GA, Kola B, Borboli N, Morris DG, Gueorguiev M, Swords FM, et al. 200.2 Sequence analysis of the PRKAR1A gene in sporadic somatotroph and other pituitary tumours. Clin Endocrinol (Oxf) 57: 443-448.
- Stratakis CA, Kirschner LS, Carney JA. 2001. Clinical and molecular features of the Carney complex: diagnostic criteria and recommendations for patient evaluation. J Clin Endocrinol Metab 86: 4041-4046.
- Beckers A, Daly AF. 2007. The clinical, pathological, and genetic features of familial isolated pituitary adenomas. Eur J Endocrinol 157: 371-382.
- Daly AF, Jaffrain-Rea ML, Ciccarelli A, Valdés-Socin H, Rohmer V, Tamburrano G, et al. 2006. Clinical characterization of familial isolated pituitary adenomas. J Clin Endocrinol Metab 91: 3316- 3323.
- Vierimaa O, Georgitsi M, Lehtonen R, Vahteristo P, Kokko A, Raitila A, et al. 2006. Pituitary adenoma predisposition caused by germline mutations in the AIP gene. Science 312: 1228-1230.
- Daly AF, Vanbellinghen JF, Khoo SK, Jaffrain-Rea ML, Naves LA, Guitelman MA, et al. 2007. Aryl hydrocarbon receptor-interacting protein gene mutations in familial isolated pituitary adenomas: analysis in 73 families. J Clin Endocrinol Metab 92: 1891-1896.
- Bell DR, Poland A. 2000. Binding of aryl hydrocarbon receptor (AhR) to AhR-interacting protein. The role of hsp90. J Biol Chem 275: 36407-36414.
- Carlson DB, Perdew GH. 2002. A dynamic role for the Ah receptor in cell signaling? Insights from a diverse group of Ah receptor interacting proteins. J Biochem Mol Toxicol 16: 317-325.
- Carver LA, Bradfield CA. 1997. Ligand-dependent interaction of the aryl hydrocarbon receptor with a novel immunophilin homolog in vivo. J Biol Chem 272: 11452-11456.
- Gu YZ, Hogenesch JB, Bradfield CA. 2000. The PAS superfamily: sensors of environmental and developmental signals. Annu Rev Pharmacol Toxicol 40: 519-561.
- Ema M, Ohe N, Suzuki M, Mimura J, Sogawa K, Ikawa S, et al. 1994. Dioxin binding activities of polymorphic forms of mouse and human arylhydrocarbon receptors. J Biol Chem 269: 27337- 27343.
- Oesch-Bartlomowicz B, Huelster A, Wiss O, Antoniou-Lipfert P, Dietrich C, Arand M, et al. 2005. Aryl hydrocarbon receptor activation by cAMP vs. dioxin: divergent signaling pathways. Proc Natl Acad Sci U S A 102: 9218-9223.
- Bolger GB, Peden AH, Steele MR, MacKenzie C, McEwan DG, Wallace DA, et al. 2003. Attenuation of the activity of the cAMPspecific phosphodiesterase PDE4A5 by interaction with the immunophilin XAP2. J Biol Chem 278: 33351-33363.
- Leontiou CA, Gueorguiev M, van der Spuy J, Quinton R, Lolli F, Hassan S, et al. 2008. The role of the aryl hydrocarbon receptorinteracting protein gene in familial and sporadic pituitary adenomas. J Clin Endocrinol Metab 93: 2390-2401.
- Georgitsi M, Raitila A, Karhu A, Tuppurainen K, Makinen MJ, Vierimaa O, et al. 2007. Molecular diagnosis of pituitary adenoma predisposition caused by aryl hydrocarbon receptorinteracting protein gene mutations. Proc Natl Acad Sci U S A 104: 4101-4105.
- Cazabat L, Libe R, Perlemoine K, Rene-Corail F, Burnichon N, Giménez-Roqueplo AP, et al. 2007. Germline inactivating mutations of the aryl hydrocarbon receptor-interacting protein gene in a large cohort of sporadic acromegaly: mutations are found in a subset of young patients with macroadenomas. Eur J Endocrinol 157: 1-8.
- Barlier A, Vanbellinghen JF, Daly AF, Silvy M, Jaffrain-Rea ML, Trouillas J, et al. 2007. Mutations in the aryl hydrocarbon receptor interacting protein gene are not highly prevalent among subjects with sporadic pituitary adenomas. J Clin Endocrinol Metab 92: 1952-1955.