Implicancias del polimorfismo de repeticiones de glutamina del receptor de andrógenos en la presentación de eventos peripuberales
María Cecilia Lardone1,a y María Verónica Mericq1
Implications of androgen receptor gene glutamine repeat polymorphism in the presentation of peripubertal events
1Instituto de Investigaciones Materno Infantil, Facultad de Medicina, Universidad de Chile.
aBioquímica, PhD en Ciencias Biomédicas.
Los autores declaran no tener conflicto de intereses
Esta publicación es parte del proyecto SOCHED 2015-05 (IR María Cecilia Lardone).
Correspondencia:
María Cecilia Lardone
Av. Santa Rosa 1234, 2° piso, Hospital San Borja Arriarán
Teléfono: +56 229770850
Fax. +56 224247240
mlardone@med.uchile.cl
Recibido: 08-06-2017
Aceptado: 02-09-2017Puberty is a period of transition during which girls and boys acquire secondary sexual characteristics and reproductive capacity. The order of appearance of the pubertal traits accounts for a correct or otherwise incorrect activation of the hypothalamic-pituitary-gonadal axis. The growth of the pubic hair before 8 years in girls and 9 years in boys (precocious pubarche, PP) without any other apparent cause has been largely attributed to the early increase of adrenal androgen levels. Also, premature adrenarche (PA) was traditionally considered an extreme within the normal range, however emerging evidence links early androgen excess with the metabolic syndrome. In this context, it has been suggested that an exacerbated clinical manifestation of androgens may be related to greater sensitivity of the androgen receptor (AR). The purpose of this review is to summarize the current knowledge of the contribution of the CAG repeats polymorphisms of AR in the peripubertal manifestations of androgens with special emphasis on precocious pubarche and body composition.
Key words: androgen receptor, CAG repeat polymorphism, pubarche, body composition.
La pubertad es el período de transición durante el cual el individuo adquiere sus caracteres sexuales secundarios y su capacidad reproductiva. Este período normal del desarrollo es el resultado de la activación de las neuronas de GnRH del hipotálamo, que a su vez activan los gonadotropos resultando en el aumento de la amplitud y frecuencia de la secreción de LH y FSH que activan la gónada. El orden en que aparecen los caracteres sexuales puede orientar a definir si la pubertad está ocurriendo en forma normal o patológica. El evento más frecuente del inicio puberal es la aparición de botón mamario (telarquia) en las niñas y el aumento del volumen testicular en los niños. En niñas, los datos más actuales en Chile indican que la media de edad de inicio de desarrollo mamario (estadio de Tanner 2) es a los 8,8 ± 0,8 años; y la pubarquia, definida como la aparición de vello púbico, inicia a los 10,3 ± 0,3 años1. Estos rangos de edad son similares a lo reportado por Herman-Giddens para telarquia en niñas afroamericanas y pubarquia en niñas caucásicas en EE. UU.2.
El crecimiento del vello púbico es dependiente de los andrógenos suprarrenales y gonadales, y es por eso que en aproximadamente un 90% de los casos es precedido por la telarquia en niñas y el aumento de volumen testicular de niños. La pubarquia precoz (PP) se define como la aparición de vello púbico antes de los 8 años en niñas y 9 años en varones. A su vez, cuando se han descartado condiciones patológicas que lo originen, se le denomina pubarquia precoz idiopática (PPi). En la etiopatogenia de la PP, se ha atribuido un rol importante al aumento precoz de los niveles de andrógenos suprarrenales3.
La zona reticular (ZR) de la corteza suprarrenal, sufre un proceso madurativo progresivo denominado adrenarquia, que se manifiesta por el aumento de la secreción del andrógeno suprarrenal dehidroepiandrosterona (DHEA) y de su éster sulfato (DHEAS)4,5. Actualmente, no se conoce claramente el factor que inicia este proceso, pero se reconocen señales tanto endocrinas, paracrinas y autocrinas6-9. A nivel molecular, el aumento de actividad liasa de P450c17 debido a un aumento de la expresión del cofactor citocromo b5, la expresión de la enzima SULT1A2, que cataliza la sulfonación de DHEA, y la baja expresión de 3β-hidroxiesteroide deshidrogenasa tipo 2 (3BHSD2) marcan la actividad funcional de esta zona10,11.
Los andrógenos suprarrenales DHEA o DHEAS no son andrógenos bioactivos, sino que actúan como precursores en los tejidos periféricos para la producción de andrógenos más potentes como testosterona y dihidrotestosterona (DHT) que actúan sobre su receptor en las células diana. La transformación de los esteroides precursores adrenales DHEAS y DHEA en andrógenos y/o estrógenos en los tejidos periféricos diana depende del nivel de expresión de las diversas enzimas esteroidogénicas y metabolizadoras en cada uno de estos tejidos12. Esta característica proporciona a los tejidos diana de otro nivel de control para la formación y el metabolismo de los esteroides ajustando a los requerimientos locales13.
La maduración temprana de la ZR, denominado adrenarquia prematura (AP), se define como la aparición de signos de acción androgénica antes de los 8 años en niñas y 9 años en niños en ausencia de pubertad central, u otras patologías secretoras de andrógenos como tumores o hiperplasia suprarrenal congénita. Simultáneamente se observa un aumento de los niveles de andrógenos adrenales (> 40 µg/dl o 1 µmol/L) para la edad y sexo4, pero en concentraciones similares a las observadas durante la pubertad. En este contexto, la AP explicaría un porcentaje de los casos de PP. Sin embargo, en los casos de PP idiopática, donde por definición los niveles de andrógenos están normales para la edad14, se ha sugerido que esta mayor manifestación clínica de los andrógenos podría deberse a una mayor sensibilidad del receptor de andrógenos (RA).
Inicialmente, tanto la aparición de PP como de AP, fueron consideradas como variantes normales del desarrollo, pero actualmente reciben más atención a medida que aumenta la evidencia que las vincula con el riesgo de sufrir distintas enfermedades metabólicas4,5.
Aspectos generales del gen y de la proteína del receptor de andrógenos
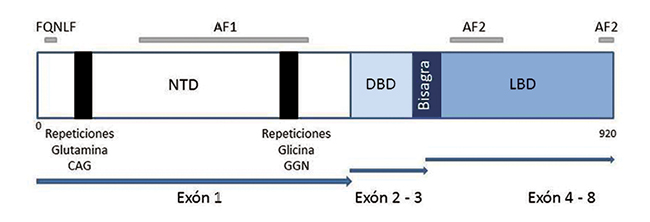
El gen que codifica el RA se localiza en la porción proximal del brazo largo del cromosoma X, posición Xq11-12, y corresponde al miembro NR3C4 de la superfamilia de receptores nucleares. El RA es una proteína de 920 aminoácidos codificada por 8 exones, la cual comparte con los demás miembros de la familia de receptores nucleares una estructura modular de tres grandes dominios: un gran dominio N-terminal variable (NTD) que precede al dominio central de unión al DNA (DBD), el cual se conecta por una región bisagra corta al tercer dominio de unión de ligando (LBD) en el extremo C-terminal. El NTD está codificado en el exón 1 y tiene función de transactivación (AF1) al interaccionar con factores basales de transcripción15,16. El dominio alberga una repetición variable de 9 a 36 residuos de glutamina (codificado por el codón CAG) y de 10 a 27 residuos de glicina (codificado por el codón GGN). Estas extensiones de repetición son polimórficas, dado que su tamaño varía entre los individuos de la población normal17,18 (Figura 1).
El principal mecanismo de acción del RA es la regulación directa de la transcripción génica. Después de la unión de la testosterona, o su metabolito DHT, se produce un cambio conformacional que causa la disociación de proteínas de choque térmico, seguido de dimerización y translocación del complejo al núcleo. El RA dimerizado se une a una secuencia específica del DNA, conocida como elemento de respuesta a andrógenos, provocando la activación o represión de la transcripción del gen diana19.
Polimorfismo del número de repeticiones de CAG y función del receptor de andrógenos
En 1991 La Spada et al.20, demostraron que la enfermedad neurodegenerativa ligada al cromosoma X llamada atrofia bulbar muscular o enfermedad de Kennedy, está causada por una extensión anormal de poliglutaminas en la proteína del RA, codificadas por más de 40 repeticiones CAG. Interesantemente, estos pacientes presentan también rasgos hipoandrogénicos, como ginecomastia, atrofia testicular e infertilidad, lo cual planteó la relación entre el largo de las repeticiones CAG y la actividad transcripcional del RA. Si bien, el deterioro de las neuronas motoras característico de la enfermedad de Kennedy se debe a la acumulación progresiva de la proteína mutada en el núcleo de estas neuronas, el polimorfismo afectaría también la capacidad de unión al DNA, la función de transactivación y el reclutamiento de coactivadores del RA21.
En este sentido, estudios in vitro, han mostrado que la variabilidad en las longitudes de la repetición de glutamina puede afectar la actividad transcripcional del receptor22-24. Los autores Chamberlein et al.23, usando construcciones del gen del RA humano con distintos números de repeticiones CAG, en un rango desde repeticiones normales hasta largas repeticiones de 77 CAG, observaron una correlación inversa con la capacidad transcripcional de este receptor sobre dos genes reporteros. Así mismo, la deleción de la secuencia codificante de poliglutamina de 22 repeticiones resultó en la exacerbación de la actividad del RA murino y humano comparado con la actividad de la versión silvestre del receptor. Por lo tanto, y teniendo en cuenta la proximidad de esta región con el dominio AF-1, estos resultados llevaron a pensar que la extensión de poliglutaminas tendría un efecto indirecto sobre la función del RA, por ejemplo causando perturbaciones estructurales dentro del dominio de transactivación. Adicionalmente, los residuos de glutamina podrían unir proteínas represoras o inhibir las interacciones del dominio de activación con su(s) proteína(s) diana por competición o impedimento estérico.
Así mismo, otros estudios advierten sobre el efecto de extensiones de poliglutamina dentro del rango normal. Buchanan et al.22, observaron una disminución en la actividad de transactivación del RA de aproximadamente 1,7% por cada repetición adicional de glutamina en un rango de 16 a 35 repeticiones. Sin embargo, esta relación lineal se perdió al analizar la acción de un constructo del RA con 9 residuos de glutamina, el cual mostró una actividad de transactivación menor a la de uno con 16 residuos debido a una menor interacción de los dominios N y C terminales. En concordancia con estos hallazgos, estudios en células humanas de cáncer de próstata muestran un aumento moderado de la actividad de transactivación de RA con una extensión de 17 repeticiones CAG, respecto de constructos con 21 repeticiones CAG, lo cual explicaría la mayor frecuencia de alelos de 17 repeticiones CAG en hombres que desarrollan cáncer de próstata agresivo25.
Dada la evidencia experimental, es posible que estos polimorfismos normales causen un efecto moderado en la función del RA y sólo se manifiesten más fuertemente cuando los niveles de andrógenos o de factores correguladores estén alterados in vivo.
Polimorfismos de repeticiones CAG del receptor de andrógenos y su relación con la pubarquia y adrenarquia precoz
Teniendo en cuenta estos antecedentes, se ha estudiado la influencia del polimorfismo del número de repeticiones CAG en la función transcripcional del RA en patologías de aparición más frecuente y sensibles a andrógenos (Revisado en referencias 26 a 30)26-30. Se ha reportado la existencia de correlación entre el largo de las repeticiones CAG y el riesgo de sufrir cáncer prostático31, cáncer mamario32, síndrome de ovario poliquístico33 y deterioro de la espermatogénesis34,35.
Específicamente en el plano del desarrollo prepuberal, un corto número de repeticiones CAG se ha asociado con pubarquia y adrenarquia precoz. Dos estudios han reportado que en niñas de origen mediterráneo (Italia y España) con PP y niveles de DHEAS elevados, la media del número de repeticiones CAG corresponde a polimorfismos más cortos que los controles sanos14,36. Si bien, los estudios no aclaran si son los polimorfismos más cortos de repeticiones CAG o el ambiente hiperandrogénico lo que favorece la aparición del vello púbico, la presencia de menor número de repeticiones junto con la aparente mayor expresión del AR en las niñas con PP puede conducir a hipersensibilidad de los folículos pilosos y, por tanto, al desarrollo prematuro del vello púbico14. Respondiendo a la hipótesis de una retroalimentación positiva por parte del RA en la secreción de andrógenos suprarrenales, son interesantes los hallazgos que sugieren que repeticiones CAG más cortas producen un aumento de la actividad del RA en el ovario y que éste tiene un efecto estimulatorio en la producción de andrógenos ováricos con un subsecuente mayor riesgo de hiperandrogenismo en niñas que habían sufrido PP36.
Asimismo, Lappalainen et al.37, encontraron que niños de ambos sexos con signos clínicos de AP presentaban polimorfismos de repeticiones CAG significativamente más cortos respecto de niños sanos, y la media del número de repeticiones de CAG fue aún menor teniendo en cuenta el cromosoma X inactivo (alelo inactivado). Los autores proponen que si bien el polimorfismo de CAG no tiene ningún papel en la retroalimentación de la secreción de andrógenos suprarrenales, la heterogeneidad de las manifestaciones clínicas de la AP podría ser modulada por los polimorfismos de repeticiones CAG del RA. Por otra parte destacan la importancia de considerar la inactivación del cromosoma X en los análisis de genes de este cromosoma, si bien en este estudio no se encontró una diferencia significativa en la frecuencia de inactivación no aleatoria del cromosoma X entre casos y controles. En congruencia con estos hallazgos, resultados no publicados de nuestro laboratorio en niñas con DHEAS elevado para su edad pertenecientes a una cohorte chilena de niños sanos, muestran una mayor frecuencia de polimorfismos de repeticiones CAG cortos (< 20 repeticiones ponderada por la inactivación del cromosoma X), sumado a una tendencia de mayor frecuencia de repeticiones CAG cortas en aquellas niñas con edad de pubarquia antes que telarquia. Desafortunadamente, en el estudio finlandés, no se hizo un seguimiento de los sujetos con el fin de observar el efecto del polimorfismo CAG en el desarrollo puberal posterior.
Contrariamente, un estudio realizado en niñas de origen asiático (Corea), mostró que el número de repeticiones CAG no está asociado a la aparición de PP38. Si bien el número de sujetos estudiados es reducido, el trabajo representa un resultado válido dado la diversidad étnica en la distribución de este polimorfismo. En este sentido, se ha reportado que la distribución y la media del número de repeticiones CAG del RA son similares en poblaciones de distintos orígenes étnicos aunque no iguales. Así, se ha observado una mediana de 21-22 repeticiones en blancos caucásicos, 22-23 repeticiones en asiáticos y de 23 repeticiones en población hispana, y 19-20 repeticiones, en población afroamericana y africana22,39.
Por otra parte, el grado de metilación del promotor o regiones regulatorias cercanas del gen del RA se correlaciona inversamente con la transcripción del gen40. En el estudio italiano antes mencionado14, se reportó una menor metilación de regiones regulatorias del gen del RA en las niñas con PP que en las niñas prepúberes de la misma edad con similares niveles de andrógenos en sangre. Además, el nivel de metilación del RA en niñas con PP, fue similar al de niños de mayor edad con el mismo grado de desarrollo del vello púbico y con mayores niveles de andrógenos adrenales14. En este sentido, la variación en la inactivación del cromosoma X por metilación dependiente de la edad, parece ser un mecanismo normal de la regulación de la expresión de este gen41. Finalmente, estos hallazgos apoyan que la presencia de un receptor más activo podría ser fundamental en la aparición del vello púbico a edades tempranas. En consecuencia, es razonable pensar que en algunas patologías los mecanismos que llevan a la normal expresión del gen del RA para la edad (ambiente hormonal, factores presentes en los centros de metilación del DNA, factores ambientales) estén desregulados, y pudieran acelerar el proceso de expresión génica y la consecuente actividad del RA.
En la mujer, uno de los dos cromosomas X se inactiva en forma aleatoria en cada célula. La inactivación convierte a uno de los dos cromosomas en transcripcionalmente inactivo a través de una serie de eventos que llevan a la condensación de la cromatina (revestimiento del cromosoma X por XistRNA, metilación del DNA, y modificación de las histonas). La inactivación del cromosoma X se produce poco después de la implantación de embriones femeninos o durante la inducción de la diferenciación celular, y el mantenimiento estable de la inactivación requiere acciones sinérgicas de varios mecanismos epigenéticos42. La metilación de sitios de restricción con HpaII, cercanos a la región de las repeticiones CAG en el gen del RA, se correlaciona con la inactivación del cromosoma X43. En esta dirección de pensamiento, los autores Vottero et al.44, estudiaron un grupo de mujeres con hirsutismo idiopático (no hiperandrogénico), concluyendo que existe una inactivación sesgada (no aleatoria) hacia el cromosoma con el alelo de repeticiones más largo en estos sujetos, dejando activo el alelo de repeticiones más corto y probablemente más sensible frente los andrógenos, lo cual explicaría su fenotipo. Los autores teorizan que la inactivación preferencial de un alelo podría ocurrir por mecanismos similares a como ocurre con la inactivación preferencial de un gen deletéreo. Sin embargo, los resultados de Calvo et al.45, no validan esta hipótesis al estudiar una cohorte más grande de mujeres con hirsutismo hiperandrogénico, no hiperandrogénico respecto de mujeres controles. No obstante, no descartan que diferencias metodológicas o de las etnias estudiadas pudiera haber influenciado en la discrepancia de los resultados.
Polimorfismos de repeticiones CAG del receptor de andrógenos y su relación con la composición corporal
Durante la pubertad se producen cambios notorios en la composición de masa corporal grasa y masa magra, así como en la adquisición de masa ósea del hueso. Estos cambios dependen principalmente de la actividad de la hormona del crecimiento y de los esteroides sexuales. En la mujer, la presencia de los estrógenos secretados por el ovario determina la adquisición de mayor masa grasa que en los hombres durante esta etapa46.
En situaciones patológicas de exceso de andrógenos, se ha reportado que niños de ambos sexos con AP presentan mayor masa grasa total y central, y que además, son más altos en estadios prepuberales comparado con controles sanos47,48. Sorprendentemente, aquellos niños con AP pero con índice de masa corporal (IMC) comparable a controles sanos, tenían polimorfismos de CAG más cortos37, lo cual hace pensar en una mayor sensibilidad del RA en la modulación de la composición corporal frente a niños con AP y polimorfismos CAG medios. En relación a la PP, Ibáñez et al.49, describe un aumento de la obesidad central (abdominal y troncal) en estas niñas a lo largo de todo el desarrollo puberal (estadíos de Tanner I a IV-V), que si bien se relaciona con un aumento de los andrógenos y de la insulina, esta relación se establece en forma similar en tanto en PP como en controles. Estos resultados dejan el interrogante de cuál será la contribución de la hiperandrogenemia en la aparición de obesidad central. En otro estudio, del mismo grupo catalán, con niñas posmenárquicas que habían presentado PP, si bien no se evaluó la composición corporal, se mostró que a menor número de repeticiones CAG del RA se producían mayores niveles de andrógenos ováricos, así como la presencia de hirsutismo e irregularidad menstrual, sugiriendo que una mayor actividad del RA tendría un efecto estimulatorio en la producción de andrógenos ováricos y que esta retroalimentación positiva podría exacerbar la gravedad de las manifestaciones del hiperandrogenismo como podría ser la distribución de la masa grasa de tipo central o androide en la posmenarquia36.
En este mismo sentido, en un estudio longitudinal en una cohorte de niños daneses sanos se encontró una tendencia a una mayor acumulación de grasa corporal en varones prepúberes con repeticiones CAG largas (24-30 repeticiones CAG) comparado con varones con un número de repeticiones medio (21-23 repeticiones CAG) de la misma edad50. Al entrar a la pubertad estos niños normalizaron sus índices de acumulación de grasa corporal, sugiriendo que el polimorfismo de repeticiones CAG afectaría positivamente la regulación de la composición corporal mediada por andrógenos antes de la pubertad, y que luego del desarrollo puberal, el considerable ambiente androgénico tendría un rol preponderante en este mecanismo. Por otra parte resulta interesante, que los niños con repeticiones cortas (17-20) presentan menor grosor de los pliegues cutáneos comparado con niños con repeticiones medias al inicio de la pubertad, lo cual apoya también el rol de los andrógenos en la distribución de la grasa corporal y el efecto modulador del polimorfismo de repeticiones CAG.
Es bien conocido que los andrógenos, mediante su receptor, tienen un efecto de estimulación de la lipólisis a diferentes niveles de esta cascada, y de inhibición de la lipogénesis51. Más controvertida es la participación de los andrógenos en la adipogénesis. Diversos estudios in vitro muestran un efecto inhibitorio de la testosterona o DHT en la diferenciación de los adipocitos51. En humanos, este efecto ha sido observado en pre adipocitos de hombres52, pero no se ha confirmado en mujeres53.
En otro aspecto del desarrollo puberal, se ha sugerido que la altura se correlaciona inversamente con el número de repeticiones CAG en varones antes del inicio de la pubertad y que esta correlación desaparece luego del inicio de la pubertad54. Así, los polimorfismos de repeticiones CAG cumplirían una función moduladora de la acción del RA mientras los niveles de andrógenos se mantienen en niveles prepuberales. Por el contrario, estos autores no encontraron una relación con índices de composición corporal. Asimismo, no se encontraron tendencias o asociaciones significativas para ninguno de los parámetros investigados en las niñas, posiblemente por el bajo número de casos estudiados.
En relación a la variabilidad en la presentación de estas manifestaciones en ambos sexos, se ha postulado que las niñas prepúberes muestran más fácilmente que los varones signos de acción androgénica, lo cual podría ser explicado por un dimorfismo sexual en la expresión de enzimas del metabolismo tisular de los andrógenos o en la activación del RA55. Así mismo el desarrollo de AP es más frecuente en niñas55.
Conclusiones
En la Tabla 1 se resumen los principales resultados de los estudios que investigan el polimorfismo de repeticiones CAG en relación a la aparición de eventos peripuberales. Si bien se destaca el escaso número de trabajos publicados, la evidencia apunta hacia un rol modulador del polimorfismo de repeticiones CAG del RA en la regulación de la acción de los andrógenos en el período peripuberal, donde todavía no se ajustan los niveles hormonales a lo que será en el adulto. La variabilidad intrínseca de la actividad de RA provocada por la presencia de coreguladores tejido-específicos, así como el metabolismo y disponibilidad tisular de los andrógenos hacen que el acercamiento a un resultado concluyente sea complejo. Teniendo en cuenta estos elementos, se ha sugerido que una mejor aproximación sería el análisis entre fenotipos y los alelos CAG como una variable discreta, y no continua la cual supone un efecto proporcional en la función del RA.
Por otra parte y dada la sorprendente falta de claridad en las bases genéticas de la adrenaquia prematura idiopática, el polimorfismo de repeticiones CAG aparece como una variabilidad genética que conlleve un factor de riesgo de sufrir AP y sus manifestaciones.
Tabla 1. Estudios que investigan el polimorfismo de repeticiones CAG del RA en relación a la adrenarquia precoz, pubarquia precoz y composición corporal
Referencia |
Sujetos |
Controles |
Población |
Mediciones y principales resultados |
| Ibáñez, 200336 | 181 niñas con PP (10,9; 4 a 19 años) y DHEAS > 40 µg/dl al momento del diagnóstico | 124 niñas sanas (baja estatura, percentiles 10-25) | España (Catalana) | Menor número de repeticiones CAG (21,3; 7-31 repeticiones vs 22; 15-32) y mayor proporción de alelos ≤ 20 en niñas con PP vs controles. En niñas PP posmenárquicas un menor número de repeticiones CAG se asoció a hiperandrogenismo ovárico |
| Vottero, 200614 | 25 niñas con PP (6,4 ± 2,4 años ) | 23 niños ambos sexos prepúberes (6,1 ± 3,4); 10 niñas en estadio de Tanner II (11,7 ± 1,5) | Caucásica (Italia) | Menor número de repeticiones CAG (20,5 ± 2,1 vs 21,4 ± 2,0) y mayor proporción de alelos ≤ 20 en niñas con PP vs niños sanos (prepúberes y Tanner II). Niveles de DHEAS similares entre casos y controles |
| Lappalainen, 200837 | 71 niños (61 F y 10 M) con AP clínica (7,4 años; 7,2- 7,7 IC95%). | 85 (67 F y 18 M) sanos (7,6 años; 7,4-7,7 IC95%). |
Finlandia | Menor número de repeticiones mw(CAG)n en casos vs controles (20,7 ± 1,7 vs 21,4 ± 2,3). mw(CAG)n se correlaciona positivamente con IMC en niños con AP. Niños con AP y IMC similar al de niños sanos, presentan menor mw(CAG)n comparado con controles |
| Kang, 201738 | 16 niñas con PP (7,7; 7,1-8,3 años ) | 16 niñas con P normal (9,1; 8,5-9,7); 16 niños (8 F y 8 M) prepúberes (7,8; 7,2-8,4). | Corea | No se observan diferencias en mw(CAG)n entre los grupos. DHEAS elevado en niñas con PP vs niñas prepúberes |
| Mouritsen, 201350 | Estudio longitudinal de 78 niños sanos (6,2-12,4 años de edad) | --- | Caucásicos (COPENHAGEN Puberty Study) | Varones con repeticiones CAG cortas (CAG 17-20) presentaron una media menor del grosor de los pliegues cutáneos a los 12 años de edad (inicio puberal) comparado con niños de la misma y repeticiones medias (21-23) |
| Voorhoev, 201154 | Estudio longitudinal de dos cohortes de sujetos sanos (n = 226, 13-36 años de edad; n = 244, 8-14 años de edad). | --- | Caucásicos (Cohorte AGAHLS y Cohorte Bonestaak) | Asociación inversa entre la altura y el número de repeticiones CAG en varones a edades tempranas |
| Lardone, datos no publicados | 58 niñas con DHEAS > 42 µg/dl a edad de 7 años | 107 niñas misma edad con DHEAS normal | Chile (Estudio Chileno de Crecimiento y Obesidad, ECO) | La media mw(CAG)n fue similar entre casos y controles. La edad de pubarquia se correlacionó positivamente con mw(CAG)n. IMC (SDS), % de masa grasa y la circunferencia de cintura (CC) se correlacionaron positivamente con DHEAS a 7 años. Casos con mw(CAG)n < 20 tuvieron menor IMC (SDS), % de masa grasa, CC en comparación con los casos con ≥ 20 < 25 mw(CAG)n a los 7 años de edad. Los indicadores de adiposidad no mostraron asociación con mw(CAG)n a la edad de telarquia |
PP: Pubarquia precoz. AP: Adrenarquia precoz. mw(CAG)n: número de repeticiones CAG ponderado por porcentaje de inactivación del cromosoma X.
Referencias bibliográficas
- Codner E, Unanue N, Gaete X, Barrera A, Mook-Kanamori D, Bazaes R,et al. 2004. [Age of pubertal events in Chilean school age girls and its relationship with socioeconomic status and body mass index]. Rev Med Chile 132: 801-808.
- Herman-Giddens ME, Slora EJ, Wasserman RC, Bourdony CJ, Bhapkar MV, Koch GG,et al. 1997. Secondary sexual characteristics and menses in young girls seen in office practice: a study from the Pediatric Research in Office Settings network. Pediatrics 99: 505-512.
- Voutilainen R, Perheentupa J, Apter D. 1983. Benign premature adrenarche: clinical features and serum steroid levels. Acta Paediatr Scand 72: 707-711.
- Idkowiak J, Lavery GG, Dhir V, Barrett TG, Stewart PM, Krone N,et al. 2011. Premature adrenarche: novel lessons from early onset androgen excess. Eur J Endocrinol 165: 189-207.
- Voutilainen R, Jaaskelainen J. 2015. Premature adrenarche: etiology, clinical findings, and consequences. J Steroid Biochem Mol Biol 145: 226-236.
- Dickerman Z, Grant DR, Faiman C, Winter JS. 1984. Intraadrenal steroid concentrations in man: zonal differences and developmental changes. J Clin Endocrinol Metab 59: 1031-1036.
- Couch RM, Muller J, Winter JS. 1986. Regulation of the activities of 17-hydroxylase and 17,20-desmolase in the human adrenal cortex: kinetic analysis and inhibition by endogenous steroids. J Clin Endocrinol Metab 63: 613-618.
- Biason-Lauber A, Zachmann M, Schoenle EJ. 2000. Effect of leptin on CYP17 enzymatic activities in human adrenal cells:
new insight in the onset of adrenarche. Endocrinology 141:
1446-1454. - Lin D, Black SM, Nagahama Y, Miller WL. 1993. Steroid 17 alpha-hydroxylase and 17,20-lyase activities of P450c17: contributions of serine106 and P450 reductase. Endocrinology 132: 2498-2506.
- Bird IM. 2012. In the zone: understanding zona reticularis function and its transformation by adrenarche. J Endocrinol 214: 109-111.
- Havelock JC, Auchus RJ, Rainey WE. 2004. The rise in adrenal androgen biosynthesis: adrenarche. Semin Reprod Med 22:
337-347. - Labrie F. 1991. Intracrinology. Mol Cell Endocrinol 78: C113-C118.
- Labrie F, Luu-The V, Labrie C, Simard J. 2001. DHEA and its transformation into androgens and estrogens in peripheral target tissues: intracrinology. Front Neuroendocrinol 22: 185-212.
- Vottero A, Capelletti M, Giuliodori S, Viani I, Ziveri M,
Neri TM, et al. 2006. Decreased androgen receptor gene methylation in premature pubarche: a novel pathogenetic mechanism? J Clin Endocrinol Metab 91: 968-972. - Chamberlain NL, Whitacre DC, Miesfeld RL. 1996.
Delineation of two distinct type 1 activation functions in the androgen receptor amino-terminal domain. J Biol Chem 271: 26772-26778. - Hughes IA, Werner R, Bunch T, Hiort O. 2012. Androgen insensitivity syndrome. Semin Reprod Med 30: 432-442.
- Lundin KB, Giwercman A, Richthoff J, Abrahamsson PA, Giwercman YL. 2003. No association between mutations in the human androgen receptor GGN repeat and inter-sex conditions. Mol Hum Reprod 9: 375-379.
- Palazzolo I, Gliozzi A, Rusmini P, Sau D, Crippa V, Simonini F,
et al. 2008. The role of the polyglutamine tract in androgen receptor. J Steroid Biochem Mol Biol 108: 245-253. - Palvimo JJ. 2012. The androgen receptor. Mol Cell Endocrinol 352: 1-3.
- La Spada AR, Wilson EM, Lubahn DB, Harding AE,
Fischbeck KH. 1991. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy. Nature 352: 77-79. - Katsuno M, Tanaka F, Adachi H, Banno H, Suzuki K, Watanabe H,
et al. 2012. Pathogenesis and therapy of spinal and bulbar muscular atrophy (SBMA). Prog Neurobiol 99: 246-256. - Buchanan G. 2004. Structural and functional consequences of glutamine tract variation in the androgen receptor. Human Molecular Genetics 13: 1677-1692.
- Chamberlain NL, Driver ED, Miesfeld RL. 1994. The length and location of CAG trinucleotide repeats in the androgen receptor N-terminal domain affect transactivation function. Nucleic Acids Res 22: 3181-3186.
- Werner R, Holterhus PM, Binder G, Schwarz HP, Morlot M, Struve D, et al. 2006. The A645D mutation in the hinge region of the human androgen receptor (AR) gene modulates AR activity, depending on the context of the polymorphic glutamine and glycine repeats. J Clin Endocrinol Metab 91: 3515-3520.
- Ding D, Xu L, Menon M, Reddy GP, Barrack ER. 2004. Effect of a short CAG (glutamine) repeat on human androgen receptor function. Prostate 58: 23-32.
- Zitzmann M, Nieschlag E. 2003. The CAG repeat polymorphism within the androgen receptor gene and maleness. Int J Androl 26: 76-83.
- Tirabassi G, Cignarelli A, Perrini S, Delli Muti N, Furlani G,
Gallo M, et al. 2015. Influence of CAG Repeat Polymorphism on the Targets of Testosterone Action. Int J Endocrinol 2015: 298107. - Xiao F, Lan A, Lin Z, Song J, Zhang Y, Li J, et al. 2016. Impact of CAG repeat length in the androgen receptor gene on male infertility - a meta-analysis. Reprod Biomed Online 33: 39-49.
- Mao Q, Qiu M, Dong G, Xia W, Zhang S, Xu Y, et al. 2015. CAG repeat polymorphisms in the androgen receptor and breast cancer risk in women: a meta-analysis of 17 studies. Onco Targets Ther 8: 2111-2120.
- Zhang T, Liang W, Fang M, Yu J, Ni Y, Li Z. 2013. Association of the CAG repeat polymorphisms in androgen receptor gene with polycystic ovary syndrome: a systemic review and meta-analysis. Gene 524: 161-167.
- Hardy DO, Scher HI, Bogenreider T, Sabbatini P, Zhang ZF,
Nanus DM, et al. 1996. Androgen receptor CAG repeat lengths in prostate cancer: correlation with age of onset. J Clin Endocrinol Metab 81: 4400-4405. - Yu H, Bharaj B, Vassilikos EJ, Giai M, Diamandis EP. 2000. Shorter CAG repeat length in the androgen receptor gene is associated with more aggressive forms of breast cancer. Breast Cancer Res Treat 59: 153-161.
- Mifsud A, Ramírez S, Yong EL. 2000. Androgen receptor gene CAG trinucleotide repeats in anovulatory infertility and polycystic ovaries. J Clin Endocrinol Metab 85: 3484-3488.
- Davis-Dao CA, Tuazon ED, Sokol RZ, Cortessis VK. 2007.
Male infertility and variation in CAG repeat length in the
androgen receptor gene: a meta-analysis. J Clin Endocrinol Metab 92: 4319-4326. - Castro-Nallar E, Bacallao K, Parada-Bustamante A, Lardone MC, López PV, Madariaga M, et al. 2010. Androgen receptor gene CAG and GGN repeat polymorphisms in Chilean men with primary severe spermatogenic failure. J Androl 31: 552-559.
- Ibáñez L, Ong KK, Mongan N, Jaaskelainen J, Marcos MV, Hughes IA, et al. 2003. Androgen receptor gene CAG repeat polymorphism in the development of ovarian hyperandrogenism.
J Clin Endocrinol Metab 88: 3333-3338. - Lappalainen S, Utriainen P, Kuulasmaa T, Voutilainen R, Jääskeläinen J. 2008. Androgen Receptor Gene CAG Repeat Polymorphism and X-Chromosome Inactivation in Children with Premature Adrenarche. The Journal of Clinical Endocrinology & Metabolism 93: 1304-1309.
- Kang MJ, Lee JS, Kim HY, Jung HW, Lee YA, Lee SH, et al. 2017. Contributions of CAG repeat length in the androgen receptor gene and androgen profiles to premature pubarche in Korean girls. Endocr J 64: 91-102.
- Esteban E, Rodon N, Via M, González-Pérez E, Santamaría J,
Dugoujon JM, et al. 2006. Androgen receptor CAG and GGC polymorphisms in Mediterraneans: repeat dynamics and population relationships. J Hum Genet 51: 129-136. - Kumar RC, Thakur MK. 2004. Androgen receptor mRNA is inversely regulated by testosterone and estradiol in adult mouse brain. Neurobiol Aging 25: 925-933.
- Sharp A, Robinson D, Jacobs P. 2000. Age-and tissue-specific variation of X chromosome inactivation ratios in normal women. Hum Genet 107: 343-349.
- Zeng SM, Yankowitz J. 2003. X-Inactivation Patterns in
Human Embryonic and Extra-embryonic Tissues. Placenta 24: 270-275. - Allen RC, Zoghbi HY, Moseley AB, Rosenblatt HM, Belmont JW. 1992. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromosome inactivation. Am J Hum Genet 51: 1229-1239.
- Vottero A, Stratakis CA, Ghizzoni L, Longui CA, Karl M, Chrousos GP. 1999. Androgen receptor-mediated hypersensitivity to androgens in women with nonhyperandrogenic hirsutism: skewing of X-chromosome inactivation. J Clin Endocrinol Metab 84: 1091-1095.
- Calvo RM, Asuncion M, Sancho J, San Millan JL, Escobar-Morreale HF. 2000. The role of the CAG repeat polymorphism in the androgen receptor gene and of skewed X-chromosome inactivation, in the pathogenesis of hirsutism. J Clin Endocrinol Metab 85: 1735-1740.
- Loomba-Albrecht LA, Styne DM. 2009. Effect of puberty on body composition. Curr Opin Endocrinol Diabetes Obes 16: 10-15.
- Utriainen P, Laakso S, Liimatta J, Jaaskelainen J, Voutilainen R. 2015. Premature adrenarche-a common condition with variable presentation. Horm Res Paediatr 83: 221-231.
- Mericq V, Pereira A, Uauy R, Corvalán C. 2017. Early BMI Gain and Later Height Growth Predicts Higher DHEAS Concentrations in 7-Year-Old Chilean Children. Horm Res Paediatr 87: 15-22.
- Ibañez L, Ong K, de Zegher F, Marcos MV, del Río L, Dunger DB. 2003. Fat distribution in non-obese girls with and without precocious pubarche: central adiposity related to insulinaemia and androgenaemia from prepuberty to postmenarche. Clin Endocrinol (Oxf) 58: 372-379.
- Mouritsen A, Hagen CP, Sorensen K, Aksglaede L, Mieritz MG, Main KM, et al. 2013. Androgen receptor CAG repeat length is associated with body fat and serum SHBG in boys: a prospective cohort study. J Clin Endocrinol Metab 98: E605-609.
- Blouin K, Veilleux A, Luu-The V, Tchernof A. 2009. Androgen metabolism in adipose tissue: recent advances. Mol Cell Endocrinol 301: 97-103.
- Gupta V, Bhasin S, Guo W, Singh R, Miki R, Chauhan P, et al.
2008. Effects of dihydrotestosterone on differentiation and proliferation of human mesenchymal stem cells and preadipocytes. Mol Cell Endocrinol 296: 32-40. - Newell-Fugate AE. 2017. The role of sex steroids in white adipose tissue adipocyte function. Reproduction 153: R133-R149.
- Voorhoeve PG, van Mechelen W, Uitterlinden AG, Delemarre-van de Waal HA, Lamberts SW. 2011. Androgen receptor gene CAG repeat polymorphism in longitudinal height and body composition in children and adolescents. Clin Endocrinol (Oxf) 74: 732-735.
- Mantyselka A, Jaaskelainen J, Lindi V, Viitasalo A, Tompuri T,
Voutilainen R, et al. 2014. The presentation of adrenarche is sexually dimorphic and modified by body adiposity. J Clin Endocrinol Metab 99: 3889-3894.